條文本
摘要
簡介戊型肝炎病毒(HEV)是發展中國家急性病毒性肝炎的主要原因,也是一個公共衛生問題,特別是在孕婦中,它可能導致嚴重或致命的並發症。重組HEV疫苗239 (Hecolin;該疫苗已在中國獲得許可,但世衛組織呼籲開展進一步研究,以評估該疫苗在脆弱人群中的安全性和免疫原性,並評估其在妊娠期的保護作用。因此,我們正在開展一項IV期試驗,以評估在孟加拉國農村地區(HEV感染流行地區)的育齡婦女接種HEV 239疫苗時的有效性、安全性和免疫原性。
方法與分析2017年10月2日,孟加拉國Matlab開始招收約2萬名16-39歲的非懷孕婦女。67個村莊以1:1的比例隨機接受HEV疫苗或對照疫苗(乙型肝炎疫苗)。目前正在進行0、1和6個月的3劑疫苗接種係列,並對婦女進行24個月的隨訪。主要結局是在孕婦中確診HEV疾病。接種疫苗後,要求參與者報告有關臨床肝炎症狀的信息。每兩周對懷孕的參與者進行一次家庭訪問,以收集有關懷孕結果的信息並篩查臨床肝炎。所有疑似肝炎病例均接受實驗室檢測以進行診斷評估。將比較HEV疫苗接種組和對照組孕婦和非孕婦中確診HEV疾病的發病率,還將評估疫苗的安全性和免疫原性。
倫理與傳播該方案由國際腹瀉病研究中心、孟加拉國研究審查委員會和倫理審查委員會、孟加拉國藥品管理局總局以及挪威區域倫理委員會審查和批準。本文基於2017年6月29日發布的協議版本2.2。我們將通過同行評審的出版物和國際會議展示研究結果。
試用注冊號該試驗在clinicaltrials.gov上注冊,注冊名稱為“評估孟加拉國戊型肝炎疫苗對孕婦保護的有效性試驗”,標識符為NCT02759991.
- 免疫學
- 流行病學
- 肝膽管的疾病
這是一篇開放獲取的文章,根據創作共用署名非商業(CC BY-NC 4.0)許可證發布,該許可證允許其他人以非商業方式分發、混音、改編、在此基礎上進行構建,並以不同的條款許可其衍生作品,前提是正確引用原始作品,給予適當的榮譽,任何更改都已注明,並且使用是非商業性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
數據來自Altmetric.com
本研究的優勢和局限性
本試驗在一個具有完善的臨床和實驗室基礎設施以及有效的轉診係統的地點,在長期人口監測登記所覆蓋的確定人群中進行。
接種疫苗後,對婦女進行為期7天的隨訪,以跟蹤並記錄任何不良事件的詳細情況。
通過每2周對所有懷孕參與者在懷孕期間進行家訪,對急性肝炎進行積極監測。
幹燥的血點用於評估疫苗的免疫原性,簡化了血液采集,並使在社區環境中儲存4萬份樣本成為可能。
該試驗設計的一個局限性是在隨訪結束時缺乏血液采樣;因此,我們將無法探討無症狀戊型肝炎的發生。
簡介
背景及理論依據
戊型肝炎病毒(HEV)是一種腸道RNA病毒,在衛生條件差的發展中國家引起暴發或地方性流行,是全世界急性肝炎的主要原因之一。1孕婦特別容易感染戊肝病毒,孕產婦死亡率、流產、早產和死產率很高。2
一種有效的疫苗可以預防易感人群有症狀的戊肝病毒感染。隻有兩種HEV疫苗在人體臨床試驗中進行了評估,即rHEV(葛蘭素史克)和HEV 239 (Hecolin,廈門Innovax Biotech,中國),其中隻有後者進行了進一步的商業開發。3.朱等在中國進行的一項大型III期臨床研究中,10萬名健康男性和女性(16-65歲)接受了HEV疫苗或乙型肝炎疫苗(HBV)。4他們發現90%以上對有症狀的HEV感染有保護作用。與疫苗相關的不良事件少且輕微,未發生與疫苗相關的嚴重不良事件(sae)。目前,該疫苗在中國僅被批準用於16歲及以上人群,並建議用於HEV感染高危人群。
世衛組織戰略谘詢專家組成立了一個工作組,審查關於HEV 239疫苗的證據,並就其使用提出建議。他們得出的結論是,知識差距阻礙了在流行國家推薦該疫苗,進一步的研究應評估該疫苗在兒童、老年人、患有基礎疾病或疾病(如免疫抑製或肝病)的人中的安全性和免疫原性,以及對孕婦的免疫原性和保護。3 5
HEV包括8種基因型,其中主要有4種感染人類。6HEV基因型1和2在發展中國家的人類感染中占主導地位。基因型3和4主要感染可進一步將病毒傳播給人類的動物,在發達國家和發展中國家都引起疾病。基因4型在中國大陸占主導地位,此前的III期疫苗試驗在中國進行,但關於疫苗對其他基因型的保護作用的數據有限。一項小型研究調查了p239接種後對基因型1 - 4的免疫原性,發現在人體內,IgG抗體對基因型1和2的反應比對基因型3和4的反應強一些,這可能是由於基因型特異性中和抗體的存在。7然而,該疫苗仍需要在其他地理區域進行測試,以充分評估對經常導致人類疾病的所有基因型的有效性。3.
我們目前正在對HEV 239疫苗進行一項IV期集群隨機臨床試驗(2017年正在進行),以提供更多關於該疫苗對基因型1的有效性和孕婦結局的數據,以及該疫苗的安全性。該試驗在孟加拉國一個以基因1型為主的農村地區進行,包括16-39歲的婦女,使我們能夠在接種疫苗後懷孕的婦女中評估疫苗的有效性和免疫原性。
目標
主要目標
確定孟加拉國農村地區育齡婦女接種HEV 239疫苗預防妊娠期HEV疾病的有效性。
二級目標
確定孟加拉國育齡婦女接種HEV疫苗的安全性。
目的:測定孟加拉國育齡婦女戊型肝炎疫苗的免疫原性。
目的:確定戊型肝炎疫苗在孟加拉國非懷孕育齡婦女中預防戊型肝炎的有效性。
評估最後一劑疫苗接種前及1個月後抗戊型肝炎IgG水平,進行一次疫苗反應,並記錄是否發生戊型肝炎疾病。
評估孟加拉國農村地區育齡婦女接種HEV疫苗的可行性、可接受性和成本效益。
探討急性戊型肝炎病例的病毒學、臨床和免疫學與結局的關係。
方法與分析
研究背景
這項臨床試驗的研究地點位於孟加拉國農村的Matlab,那裏是HEV的地方病。8孟加拉國國際腹瀉病研究中心(腹瀉病研究中心,b)在這一領域維持了一個實地研究地點50多年,並有一個覆蓋全體人口的持續健康和人口監測係統。icddr,b駐地包括67個村莊,總人口約116 000人,有完善的基礎設施,包括保健服務(醫院和地方保健診所)、實驗室設施和有效的轉診係統。
隨機和盲法
所有67個村莊以1:1的比例隨機接受HEV疫苗或HBV疫苗。所有參與者、調查人員和現場工作人員都被失明。然而,疫苗管理人員不能盲目接種,因為在孟加拉國,18歲以下和18歲以上的婦女所接種的HBV疫苗劑量是不同的,而所有年齡組的HEV疫苗劑量是相同的。每個村莊分配兩個疫苗代碼(一個用於16-18歲,另一個用於19-39歲),共8個代碼;每個年齡組的每種疫苗都有兩個編碼。為了在不同年齡組中實現兩種疫苗代碼的相似分布,考慮到村莊的人口規模,采用了計算機分配。重新進行隨機分組,直到各組的大小平衡(差異<200)。來自約翰霍普金斯大學的獨立統計學家進行了隨機分組。這些小瓶由孟加拉國的Incepta製藥公司貼上了8個不同的代碼,該公司從中國批量裝運成品疫苗並將其裝入瓶中。
治療分配代碼被妥善保管,研究者隻有在對參與者的治療分配的了解可能會影響她或臨床護理或如果事件是意外的並懷疑與研究產品有因果關係的情況下才可以破譯。密碼破解將在24小時內報告給臨床監測和數據安全和監測委員會(DSMB)。除非受試者符合任何方案規定的排除標準,否則盡管摘除了盲眼,她仍可繼續進行方案規定的隨訪。
招聘及報名
通過現有的Matlab監測係統確定的研究區內所有符合條件的女性,將由指定的研究工作人員在其家中聯係,他們將根據良好臨床實踐國際協調會議(ICH)以當地語言告知研究的性質,參與者可以詢問研究的細節。資格進一步評估,根據納入和排除標準箱1.
戊型肝炎病毒孟加拉國研究納入和排除標準
入選標準
首次接種疫苗時年齡為16-39歲的健康非懷孕女性
生活在孟加拉國國際腹瀉病研究中心的實地基地Matlab,孟加拉國
自願給予書麵知情同意
排除標準
懷孕(可見或口頭報告上一次月經日期或驗孕尿)
對疫苗或疫苗成分有嚴重過敏反應史
2周內接受另一種疫苗或免疫球蛋白
嚴重慢性病(醫學評估)
急性或慢性傳染病(醫學評估)
發燒>38°C(腋窩溫度)
為錯過經期的婦女提供尿妊娠測試。合資格的參加者到固定地點的診所報名,並簽署同意書。在16-17歲的參與者的情況下,他們的法定監護人簽署了一份同意書來代替同意書。然後為每個參與者創建帶有識別號碼的病例報告表格(CRF)。個人識別碼的機密性是透過將主要資料文書中所記錄的姓名保存在安全檔案中,並從電腦化數據集中刪除姓名以供分析。預期招募參與者的流程圖見圖1.
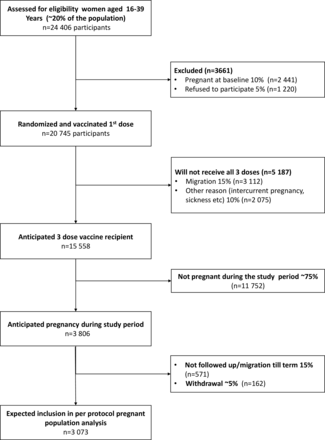
預期參加者報名流程圖。
撤軍
參與者和/或他們的法定監護人被告知,參與是自願的,他們可以在任何時候撤回同意,無需給出理由,也不影響進一步的治療。退出的參與者可以要求銷毀樣本和刪除有關自己的數據。在安全原因或重大方案偏差的情況下,研究者可以隨時終止參與者的研究。退出的原因將記錄在CRF內。如果是由於不良事件,將安排適當的隨訪。
幹預措施
HEV 239疫苗基於一個239個氨基酸的長重組HEV肽,對應於編碼HEV衣殼蛋白的開放閱讀框2的368-606氨基酸。該氨基酸序列來源於中國HEV基因型1株。HEV 239是由Innovax公司開發和生產的。疫苗表達於大腸杆菌,9並含有30µg純化蛋白,吸收到0.8 mg氫氧化鋁中,懸浮在0.5 mL緩衝鹽水中。對照疫苗是由Incepta公司生產的商用乙肝病毒(Hepa-B)。每0.5 mL劑量(16-18歲)含有10µg乙型肝炎表麵抗原,吸收於相當於鋁的氫氧化鋁凝膠上3 +0.25毫克。老年人1.0 mL劑量含有20µg乙型肝炎表麵抗原,吸收於相當於鋁的氫氧化鋁凝膠上3 +0.5毫克。我們選擇這種控製疫苗的原因如下:它將使未通過兒童免疫接種計劃接種這種疫苗的目標人群受益;給藥方案與戊型肝炎疫苗相同;這是三期試驗中的對照疫苗,4便於與以前的結果進行比較。
Innovax為試驗捐贈了散裝HEV疫苗,而Incepta分別將HBV和HEV疫苗裝入相同的單劑量小瓶中。散裝疫苗和成品均根據ICH-Good Manufacturing Practice進行了質量檢測和標記。
Innovax通過快遞向孟加拉國Incepta捐贈散裝疫苗,維持冷鏈。Incepta製備了HEV單劑量疫苗小瓶。我們維護了從inception到現場的冷鏈。
疫苗分別於第0天、第1個月和第6個月在兩側手臂三角肌肌內注射,分3劑(表1).
跟蹤/監控
在最後一名參加者登記後,整個研究期將持續兩年半(表1).
肝炎的監測
參與者將獲得帶有身份證號碼和電話號碼的免疫接種卡,如果他們出現黃疸或至少3天出現以下任何症狀:疲勞、食欲不振、腹部不適、右上腹疼痛、惡心或嘔吐,請立即與研究者聯係。在整個研究期間,對所有參與者進行肝炎的被動監測。每次接種疫苗後,實地工作人員連續7天每天走訪參與者的家庭。然後,現場工作人員每周對所有參與者進行肝炎監測,並將持續到研究結束。每兩周對任何劑量後懷孕的所有婦女進行一次訪問,以收集有關妊娠結局的信息並篩查臨床肝炎。此外,還通過移動電話向所有參與者發送有關肝炎症狀的信息(>80%的家庭有手機接入)。疑似病例將轉到Matlab醫院進行臨床和實驗室檢查,包括肝功能檢查和肝炎(A、B、C、E)病毒學原因檢查,並最終進行治療。如果通過存在抗HEV IgM或HEV RNA確認HEV疾病,將對血液樣本進行相關生化、微生物和免疫學標記物分析。這包括病毒載量、HEV亞型、其他肝炎感染、抗體滴度、細胞免疫反應、細胞因子、穀丙轉氨酶(ALT)、國際標準化比值(INR)和白蛋白。在康複之前,每周至少抽取兩次血液樣本,以評估疾病期間病毒和宿主因素的動態。 The patient’s symptoms and signs will also be recorded regularly in this period. The last study visit to pregnant women is 14 days after delivery, to record information on the health status of the child.
不良事件監測
在每次接種疫苗劑量後,對參與者進行30分鍾的觀察,並由現場工作人員連續7天到他們家中進行訪問。在這些訪問中,特別詢問參與者是否有局部反應(如注射部位的紅斑、腫脹、硬化和疼痛)和全身症狀(如惡心、不適、肌痛、關節痛、頭痛和發燒)。參與者還被要求報告最後一劑疫苗接種後的任何顯著症狀,即直到最後一次研究訪問至少2年。在這次訪問之後,建議他們向研究小組報告任何可能的急性急性呼吸道綜合征或肝炎跡象,即使在研究完成之後。
結果
主要結局是孕婦臨床戊型肝炎。HEV疾病的定義為病程持續至少3天,血清ALT異常≥正常上限的2.5倍,發病後1個月內采集的血清中檢測到IgM抗HEV,和/或配對血清中存在HEV RNA和/或IgG抗HEV水平≥4倍的升高。所有急性肝炎病例還檢測了其他病毒性肝炎(A、B、C)標誌物的存在。次要結局是在非孕婦中確認HEV疾病、安全性和免疫原性。安全性結果包括所有局部和全身不良事件,在研究期間記錄在參與者病例報告表中。疫苗誘導免疫反應的調查將包括所有參與者的抗戊型肝炎IgG,以及來自50名參與者亞群的血漿和外周血單個核細胞(PBMC)樣本中的其他抗體和細胞反應。將尋找可能具有保護性的抗hev IgG水平。疫苗接種的抗體反應定義為個人疫苗接種後樣本(最後一次劑量後1個月)與基線樣本相比IgG抗hev水平升高≥4倍。4將在懷孕報告表上收集所有參與者的妊娠結局數據,包括分娩期間的並發症和母親和兒童的健康狀況,並與最終的HEV疾病記錄以及疫苗劑量的類型、時間和數量一起分析。
樣本大小和功率計算
在每個方案(PP)分析中,計算樣本量以估計懷孕參與者的疫苗總保護率(圖1).以下假設是基於Matlab健康和人口監測係統的數據以及該地區以前的HEV研究。8我們預計將有10%的女性因為基線懷孕而不被包括在內,拒簽率將為5%。隨機分組後,將有15%的人因遷移出研究地點而失去時間,10%的人因其他原因無法完成三劑疫苗。在最後一劑疫苗接種後的隨訪中,我們假設16%的婦女(平均隨訪16個月)將在監測結束前懷孕並足月;另外9%的女性(平均隨訪9個月)將被隨訪平均半個足月(4.5個月)。這預計劑量3的接受者中有20%將“完全”懷孕,3806人預計在劑量3後懷孕,3073人將一直懷孕到足月。對剩餘妊娠的隨訪將通過終止隨訪進行權利審查。我們預計15%的妊娠劑量3接受者將因遷移而失去隨訪,而5%預計將退出研究。我們預計該聚類隨機試驗的設計效果為2。我們假設22%的參與者在基線時HEV血清呈陽性,表明對HEV感染有保護作用。8此外,6%的血清陰性孕婦預計會在懷孕期間被感染,8我們認為其中35%是有症狀的。83劑HEV疫苗方案對症狀感染的保護效力為>95%。4因此,我們需要基線樣本量為20745名婦女,以便在孕婦中進行分析時達到80%的功率(p<0.05)(雙尾)。此外,我們的研究將有90%的能力顯示>對非孕婦HEV疾病的95%保護效力。我們的研究不能直接評估圍產期和孕產婦死亡,因為在Matlab中這些結果的發生率很低。然而,鑒於大量證據表明孕產婦和圍產期死亡率與妊娠期HEV疾病有關,2證明疫苗對妊娠期確診的HEV疾病具有保護作用,將為接種疫苗可能預防孕產婦和圍產期死亡提供強有力的證據。
數據收集、管理和分析
外地工作人員正在通過在接種疫苗和家訪期間進行訪談,並酌情審查醫療記錄,將所需數據輸入紙質crf。在門診就診一周內,數據進一步轉錄到電子數據捕獲係統(由icddr開發,b使用Oracle數據庫)。該係統將自動檢查數據以檢測錯誤和不一致。分析程序員每周檢查係統中的數據,從主數據庫中刪除的任何數據都將保存在一個影子表中。數據存儲在Oracle數據庫係統的中央服務器Matlab。數據管理團隊每周對數據庫進行一次電子備份,並將最終的數據庫發送到icddr,b數據歸檔係統。
研究參與者的健康登記數據及其以前的懷孕結果也正在收集中。外地工作人員和醫務人員正在與家屬記錄簿核對這些數據。每次訪問後,他們都會與符合條件的參與者名單核對參與者數據。數據分析經理每兩周驗證輸入的數據。任何不一致的地方都由外地工作人員和醫務幹事解決。
所有完成的crf和其他文件都儲存在一個上鎖的櫃子裏,限製人員進入。Matlab數據管理中心中的CRF寄存器跟蹤檔案櫃和數據管理中心之間的CRF移動。日誌簿包含這些列;與會者編號、接收日期、訪問編號、頁數、工作人員姓名、文件移動目的、返回日期、工作人員姓名及任何相關備注。所有知情同意書都被歸檔並單獨保存在一個上鎖的櫃子裏。數據錄入電子數據庫。一個專門的數據管理團隊將負責數據的錄入、清理、分析和以不識別的方式存檔。
血液樣本由icddr、b和(或)挪威公共衛生研究所根據預先確定的標準操作程序進行分析。額外的血液將儲存在icddr,b的研究生物庫中,以防需要重新分析。
統計方法
分析
在初步分析中,接受HEV疫苗的孕婦確診HEV疾病的風險將與接受HBV疫苗的婦女的風險進行比較,使用Cox回歸與共同虛弱。10調整集群隨機化的設計效果。將比較所有參與者的HEV和HBV疫苗接種組群的人口統計學和其他基線特征,並單獨對懷孕參與者進行比較,以評估實現隨機化的程度。不平衡的協變量(例如,職業、年齡、體重指數(BMI)、乙型肝炎疾病、社會經濟信息、教育、衛生和用水、距離河流的距離、季節、基線HEV IgG抗體)可能包括在模型中。亞組分析將分別評估基線時抗戊型肝炎IgG抗體陰性/陽性的參與者的有效性,也將對每劑量接受的劑量進行有效性亞組分析。此外,將進行亞組分析,以探索不同BMI和年齡區間的參與者的有效性。所有局部和sae(如疼痛、腫脹、紅腫、發熱、肌痛和頭痛)的安全性分析將使用邏輯回歸的廣義估計方程來解釋聚類隨機化
分析集
完整分析集(FAS)人群將包括所有接受至少一劑研究疫苗或對照疫苗的隨機參與者。PP人群將包括隨機分組並分別接受三劑研究疫苗或對照疫苗的參與者,並根據方案時間表提供血液樣本(表1).懷孕的FAS和PP人群被定義為在研究期間確認懷孕的各自人群的參與者。將對妊娠PP人群進行初步有效性分析。將對懷孕的FAS人群,以及非懷孕的FAS和PP人群進行二次有效性分析,方法與主要分析相同。將對FAS人群進行安全性分析。
數據和安全監控
數據監控
一個沒有競爭利益的獨立DSMB被任命為icddr,b倫理審查委員會(ERC)提供該研究的全麵科學、安全和倫理評估。DSMB還通知本委員會關於研究的進展,特別注意參與者的安全。他們每年至少召開一次會議,並直接向倫理委員會主席提出建議。正如ERC指南所述,在每次會議前,首席研究員向DSMB準備一份報告,描述累積的不良事件和不良事件,以及當前納入的數據摘要、進展和方案或計劃程序的偏差。任何來自監督員關於質量控製的報告也包括在內。DSMB還負責詳細審查所有sae。更多細節可在孟加拉國試驗辦公室試驗主文件中包含的DSMB章程中找到。
沒有計劃進行中期分析,也沒有為試驗製定停止指南。如果出現嚴重的安全問題,DSMB將開會提出關於終止試驗的建議。督導委員會有終止研究的最終決定權。
危害
所有觀察到或報告的不良事件均由研究人員記錄在相關參與者CRF中。登記以下信息:不良事件的描述(精確的標準醫學術語)、發病時間和緩解時間、嚴重程度(輕度/中度/嚴重;根據不良事件通用術語標準4.0版),結果,研究藥物的因果關係評估和研究藥物采取的措施。
所有sae在研究人員發現後24小時內通知DSMB。SAE報告最初發送給DSMB主席和ERC,並將副本發送給發起人/首席研究員。正在對所有不良事件和緊急事件進行隨訪直至解決,除非研究者認為該事件由於潛在疾病而不太可能解決。我們將努力解決所有事件,即使他們在研究結束後繼續。
審計
主辦方(NIPH)指定了一名獨立的當地臨床監督員,以確保研究按照方案、標準操作程序、GCP和法規要求進行,並驗證研究人員正在收集和報告高質量的數據。此外,來自NIPH的一名監督員正在對該研究進行審計。監控器定期在現場進行監測,包括在研究開始時和結束時。監測員檢查隨機分布在67個研究村的至少10%的研究參與者的知情同意程序、不良事件報告和其他安全數據、CRF完整性和對研究方案的遵守情況。他們還監督監管文件的維護,研究供應責任,設施和設備。
患者和公眾參與聲明
公眾沒有參與研究問題的發展,也沒有參與研究設計。
倫理與傳播
該議定書已獲得icddr、ERC和挪威區域倫理委員會的批準。
協議的修正案
研究方案的任何重大修訂和/或新版本將在實施更改前根據歐盟和國家法規通知兩國主管部門和倫理委員會並獲得批準。
保密
所有與學習相關的信息都是保密的,被鎖起來,或者在安全的服務器上,以防數字信息。研究監督員、ERC和任何執法機構隻有在必要的檢查時才能獲得這些信息。樣品可送往國外進行分析,並在適用的情況下保存5年;但是,任何可識別個人身份的信息將在安全條件下保存和處理,僅限預先識別的工作人員訪問。其餘血液樣本將在完成所有參與者的檢測後處理。
訪問數據
研究首席研究員、研究中的合作研究員和數據分析經理將有權訪問最終的試驗數據集。
傳播策略
在研究完成並最終確定研究報告後,我們將根據國家規定將研究結果提交主管部門和倫理委員會,並在同行評審期刊上發表。我們將根據試驗報告綜合標準指南報告試驗,作者身份基於ICMJE建議。
致謝
icddr,b感謝挪威研究理事會通過GLOBVAC計劃支持這項研究。icddr,b還感謝孟加拉國、加拿大、瑞典和聯合王國政府提供核心/無限製支助。作者感謝icddr (b)研究團隊的所有成員,他們幫助招募參與者、接種疫苗、取樣和隨訪,以及icddr (b)實驗室團隊,他們執行了實驗室程序。感謝當地臨床監督員(Wasif Ali Khan)對試驗的監督。作者還感謝數據安全監測委員會(Kazi Zulifiquer Mamun, S M Shamsuzzaman, Saria Tasnim, Md. Nur Haque Alam和Hanne M. n æ kleby)和指導委員會(Shams El Arifeen, Rashidul Haque, Ingeborg Aaberge和Geir Bukholm)在整個試驗過程中做出的重要貢獻。特別感謝Innovax公司捐贈的戊型肝炎疫苗。nih是本次臨床試驗的發起人(聯係人姓名:Susanne Dudman)。地址:挪威公共衛生研究所,Postboks 222 Skøyen, 0213 Oslo, Norway)。
腳注
推特@Asma阿齊茲
發表於作者於2017年在挪威特隆赫姆舉行的第10屆全球健康和疫苗接種研究會議(GLOBVAC)上展示了該研究的海報。
貢獻者JDC, KZ, SD, KS-J, FQ, MY, SS, JO, ESG, JLD, QN, AR, PKS, JK和CHJ對研究設計有貢獻。KZ、JDC、AA、MK、SD、KS-J、JO、SS、TRB、MR、WH、JLD、CHJ參與試驗管理。CHJ、KS-J、SD、JDC、KZ、SS、JLD、JO、ESG參與稿件撰寫和編輯。KZ, AA, MK和WH負責管理研究的現場團隊/後勤。所有作者都閱讀並批準了最終的手稿。
資金挪威研究委員會通過GLOBVAC計劃(項目號248143)支持了這項研究。中國廈門Innovax生物技術公司提供了散裝HEV 239疫苗。SGD得到挪威國家衛生研究院和奧斯陸大學的支持,KSJ和JLD還得到挪威國家衛生研究院的額外支持,挪威國家衛生研究院還提供統計學家、技術工程師、疫苗專家的額外支持,並提供實驗室設施和儀器。研究的設計、管理、分析和報告完全獨立於疫苗製造商。
相互競爭的利益沒有宣布。
患者發表同意書獲得的。
倫理批準該試驗得到了icddr、b研究審查委員會和倫理審查委員會以及孟加拉國藥品管理局總局的批準。此外,它已獲得挪威區域倫理委員會的批準。
出處和同行評審不是委托;外部同行評審。


