條文本
摘要
簡介十多年來,低劑量阿米替林和米氮平都是處方外治療失眠的處方藥。然而,這些抗抑鬱藥物治療失眠的安慰劑對照證據仍然缺乏。因此,本試驗旨在評估低劑量阿米替林(10-20 mg/天)和米氮平(7.5-15 mg/天)在全科治療中對難以維持睡眠或清晨醒來問題的失眠障礙患者的有效性。
和分析方法藥物再發現:低劑量阿米替林和米氮平用於全科(DREAMING)失眠障礙的研究是一項隨機、雙盲、安慰劑對照試驗,涉及約50個全科。患有失眠症的成年人(18-85歲)(《精神障礙診斷和統計手冊》-5)在非藥物治療無效的情況下,向全科醫生(GP)谘詢睡眠藥物是符合條件的。排除標準:孤立性睡眠啟動問題,阿米替林或米氮平的禁忌症或藥物-藥物相互作用。受試者(n=156)將被隨機分配到三個平行治療組,為期16周,在常規全科醫生治療的同時,服用阿米替林(1或2片,10mg /天)或米氮平(1或2片,7.5 mg/天)或安慰劑(1或2片)。所有參與者開始和結束都是單劑,但在第3周全科醫生會診後,劑量可以翻倍。將在基線、第6周、第12周、第20周和第52周進行問卷評估。主要研究結果是6周時自我報告失眠嚴重程度,用失眠嚴重程度指數(ISI)進行測量,目的是進行治療分析。次要結果包括由睡眠指數量化的主觀睡眠質量、日間功能和症狀、安全性和治療評價以及其他睡眠護理消費。
道德和傳播阿姆斯特丹自由大學醫療中心的醫學倫理委員會批準了這項試驗。這項試驗的結果將發表在同行評審的科學期刊上,並在相關學術會議和向關鍵利益攸關方展示。
試驗注冊號碼NTR7449。
- 睡眠醫學
- 初級護理
- 睡眠醫學
這是一篇開放獲取的文章,按照創作共用署名非商業性(CC BY-NC 4.0)許可發布,該許可允許其他人以非商業性的方式發布、混編、改編、構建本作品,並以不同的條款授權他們的衍生作品,前提是原創作品被正確引用,給予適當的榮譽,任何更改都被注明,且使用是非商業性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
來自Altmetric.com的統計
本研究的優勢和局限性
該研究解決了一個國際公認的研究問題,即用低劑量抗抑鬱藥治療失眠障礙的有效性。
語用設計保證了研究結果對全科護理的外在普遍性。
除了對睡眠的短期影響,日間功能和長達1年的16周試驗治療的長期影響也將進行評估。
該研究包括兩種與全科治療相關的知名抗抑鬱藥,即阿米替林和米氮平與安慰劑的對比。
在一般實踐中,一個實用的低風險藥物試驗會麵臨實際和後勤方麵的挑戰,包括患者納入率。
簡介
背景
失眠症是一種影響睡眠和日常生活的普遍疾病,約占人口的6%。1根據《精神障礙診斷與統計手冊-5》(DSM-5),失眠障礙的診斷是基於臨床評估的一個主要抱怨,即在超過3個月的時間裏,每周有3天或更多的時間對睡眠數量或質量不滿意,導致白天有明顯的障礙,盡管有充足的睡眠機會。2患者可能會出現難以入睡、難以維持睡眠和清晨醒來且無法再次入睡的情況。除了難以治療外,失眠還與各種重大的身心健康後果有關,如心血管疾病和抑鬱症的風險增加。beplay体育相关新闻3 4在歐洲,每位失眠患者每年的間接成本估計為1472歐元,主要原因是工作效率的喪失。5個6
認知行為失眠療法(CBT-I)在國際上被認為是治療失眠障礙的首選療法,7 - 10因為與藥物治療相比,它的長期療效更大,副作用更少。11日12CBT-I包括刺激控製、睡眠限製、放鬆和有組織的鍛煉,對睡眠效率和失眠嚴重程度有中等到較大的影響。13日14盡管如此,許多失眠症患者都接受睡眠藥物治療。造成這種差異的原因包括CBT-I的可得性和使用有限,全科醫生(gp)在提供和使用CBT-I方麵缺乏知識和信心,以及患者在開處方方麵的壓力。15此外,CBT-I並不是對所有患者都有效,因為據報道,近40%的患者在治療後沒有達到緩解11一些患者可能仍然需要睡眠藥物來治療失眠症狀。16
失眠的藥物治療通常包括苯二氮卓受體激動劑(即苯二氮卓和所謂的“z藥”)。這些催眠藥物通過增強中樞神經係統中-氨基丁酸的抑製作用來誘導睡眠。盡管BZRAs藥物有短期療效,但其使用可能導致嚴重的不良反應,即非恢複性睡眠和副作用,如嗜睡、夜間混亂、記憶喪失、跌倒、快速發展的耐受性、依賴性和反彈效應。10 17 18
十多年來,臨床醫生以低劑量(即低於抗抑鬱療效的劑量)開出各種具有鎮靜作用的抗抑鬱藥作為BZRAs的替代品。15個月19號根據它們的藥理作用機製(即,在低劑量拮抗組胺h1受體介導的中樞神經係統的喚醒促進活動),這些抗抑鬱藥可能對治療睡眠維持問題特別有效。24然而,大多數通常開出的抗抑鬱藥並沒有被批準用於治療失眠,也沒有科學證據證明它們的使用。在荷蘭和國際上,特別是低劑量阿米替林和米氮平在適應症外被大量開出。15 19 252018年,Cochrane發表了一篇關於抗抑鬱藥物在成人失眠治療中的使用的綜述,呼籲開展高質量的抗抑鬱藥物治療失眠的試驗,為臨床實踐提供更好的證據。26在這篇綜述中,發現多塞平在短期內對睡眠質量和睡眠維持有微小的積極作用,該藥物於2010年被美國食品和藥物管理局批準用於治療伴有睡眠維持問題的失眠,的觀眾曲唑酮。26埃斯米氮平是米氮平的左對映體,最近在行業資助的隨機安慰劑對照試驗中被研究用於治療失眠。31然而,直到今天,盡管它們的普遍使用,沒有安慰劑對照試驗的證據表明低劑量阿米替林和米氮平對失眠障礙的有效性。
因此,我們設計了藥物再發現:小劑量阿米替林和米氮平治療全科(DREAMING)失眠障礙的研究;一項隨機、雙盲、安慰劑對照的實用試驗。本試驗的結果將具有臨床相關性,因為它們將支持或反對使用這些藥物作為(初級保健)失眠障礙患者的有效、安全和通用的替代藥物治療,如果單靠非藥物治療方法是不夠的。
目標
主要研究目的是評估低劑量阿米替林和米氮平分別與安慰劑在全科治療中難以維持睡眠或清晨醒來問題的失眠障礙(DSM-5)患者的療效(1)自我報告的失眠嚴重程度。次要目標是評估(2)治療期間和治療後對自我報告的睡眠質量和睡眠(日記)指數的有效性,(3)治療期間和治療後白天症狀和功能的有效性,(4)治療耐受性(副作用、停藥症狀、評估),(5)治療是否充分,或在治療期間或治療後要求額外的睡眠藥物(最多1年)。
和分析方法
研究設計
dreams研究是一項由研究人員發起、隨機、雙盲、安慰劑對照、多中心III期試驗,在初級保健環境(全科實踐)中有三個平行治療組,比較阿米替林和米氮平與安慰劑。
dreams研究是實用主義設計的。首先,臨床合格性由患者自己的全科醫生評估,患者的選擇標準盡可能接近日常實踐中超說明書低劑量阿米替林和米氮平的目標人群。其次,參與治療的患者仍然在自己的常規治療中接受治療,包括試驗治療和非藥物失眠治療。第三,我們的幹預措施反映了目前的做法,包括劑量(10-20毫克阿米替林或7,5 - 15毫克米氮平),通常的處方期(約16周,旨在實現持續的睡眠改善),並在約3周後,如果尚未達到預期效果,將劑量增加一倍。這種實用的設計不僅有助於結果的普遍性,而且據說也有助於研究藥物的可接受性,並將導致研究退出率低。dreams研究由位於荷蘭阿姆斯特丹VUmc的阿姆斯特丹大學醫學中心(UMC)全科醫學部協調,將在阿姆斯特丹地區的50多個全科醫學部進行。該試驗是根據國際協調會議良好臨床實踐條例(ICH-GCP)進行的。32研究方案的報告遵循隨機試驗標準方案項目建議和實用試驗擴展(試驗報告綜合標準,CONSORT聲明)。33 34圖1顯示與會者時間線。試驗將在2019年1月至2022年夏季期間進行;在與資助機構協商後,計劃納入的時間延長了1年,至2021年夏季。
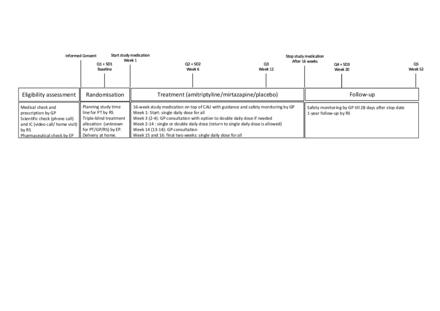
參與者時間線。問卷(Q)填寫關於過去2周。睡眠日記(SD)被預先填寫了一周。CAU,關懷如樸實;EP,實驗製藥VUmc;全科醫生、全科醫生;RS,研究人員;協調研究員或專職研究助理;PT,參與者。
一般的做法
在荷蘭,失眠的治療主要是在初級保健中進行的。絕大多數非機構公民都在一家全科診所注冊。全科醫生根據荷蘭全科醫生學院的國家醫療指南工作。在參與的全科醫生的試驗說明中,我們明確提到要遵循荷蘭NHG關於睡眠問題的一般實踐指南,35長期睡眠問題的首選治療方法是非藥物治療,特殊情況下可考慮短期藥物治療(BZRA處方最多10片)。在這項研究中,來自參與診所的全科醫生評估失眠谘詢的醫療資格,開研究藥物,在兩次谘詢中評估試驗治療,並從開始日期到停止日期後28天進行安全監測。此外,在整個研究過程中,他們的常規護理仍在繼續。由於後勤方麵的原因,隻有阿姆斯特丹地區的一般實踐才能參加。
合格標準
簡單地說,目標群體包括在全科治療中被診斷為失眠障礙的成年人,有難以維持睡眠或清晨醒來的問題,患者和全科醫生認為非藥物治療是不夠的。納入和排除標準列於箱1.
納入和排除標準。
入選標準:
失眠障礙,根據《精神障礙診斷與統計手冊-5》(DSM-5)標準進行臨床評估,即在超過3個月的時間裏,每周有3天或3天以上的時間對睡眠數量或質量不滿意的主要主訴,導致盡管有充足的睡眠機會,但白天有明顯的障礙(DSM-5)。2
根據荷蘭全科指南(包括睡眠衛生建議和認知行為方法)的非藥物治療被患者和全科醫生(GP)認為是不夠的。
向全科醫生谘詢睡眠藥物,但不包括偶爾偶然的夜晚或特定時期(如旅行)。
年齡在18至85歲之間*
在治療和安全監測期間,作為參與全科實踐之一的患者。
排除標準:
失眠繼發於其他疾病,例如阻塞性睡眠呼吸暫停綜合征(OSAS),伴發重度抑鬱症,慢性疼痛。
阿米替林或米氮平是禁忌症,或根據一般護理的全科醫生所知的信息,會造成額外的風險,即阿米替林或米氮平過敏;心律失常/心髒阻斷/長QT綜合征/Brugada綜合征/急性心源性死亡家族史/近期心肌梗死(過去90天內)/心絞痛/冠狀動脈功能不全;嚴重腎功能不全(腎小球濾過率,GFR <10);嚴重肝功能異常;癲癇;眼高血壓/青光眼;雙相情感障礙;同時酗酒或吸毒/成癮;自殺風險;根據全科醫生的說法,由於已知的不穩定的健康狀況,
懷孕、哺乳期或希望在未來6個月內懷孕者
絕症。
潛在的藥物-藥物相互作用:長期使用精神藥物(包括抗焦慮藥、傳統抗抑鬱藥、抗精神病藥、抗驚厥藥和興奮劑);同時使用口服抗真菌藥;酶誘導劑,抗逆轉錄病毒藥物,西咪替丁和可樂定。
過去一年服用阿米替林或米氮平治療失眠。
無法按照研究指導填寫研究問卷(荷蘭語)。
孤立的睡眠啟動問題(即沒有維持睡眠或清晨醒來的問題)
定期上夜班。
希望繼續服用(非處方)含有褪黑素、聖約翰酒、大麻或抗組胺的睡眠輔助藥物。
幹擾藥物再發現的臨床幹預研究:小量阿米替林和米氮平治療全科幹預和研究程序中的失眠障礙。
招聘和同意
在大約2年的納入期內,由參與的全科醫生在常規護理中招募參與者。資格評估由全科醫生、協調研究員或專門的研究助理(下稱“研究員”)和阿姆斯特丹UMC實驗藥房(下稱“實驗藥房”)的調劑藥劑師連續三步執行:
全科醫生:在定期谘詢請求睡眠藥物的失眠患者時,檢查其醫療資格(納入和排除標準1-15)。如果適用,全科醫生會簡要地告知患者研究的目的和設置,並詢問他/她是否有可能有興趣參與。如果是這種情況,患者書麵同意全科醫生與研究人員分享他/她的聯係信息。
研究員:打電話給患者(A)以驗證(科學的)合格性(標準1、8和13-16),(B)詢問患者的主要睡眠問題類型(即,夜間頻繁醒來與早上或晚上過早醒來並難以再次入睡),以達到分層目的,(C)告知符合條件的患者研究設置並提供回答問題的機會,(D)發送信息包(小冊子,通知同意書)並安排後續會議(在患者家中或(如果願意的話)在其他地方,例如在阿姆斯特丹UMC所在地VUmc或在COVID-19措施期間通過視頻電話)。會議的目的是回答任何剩餘的問題並獲得知情同意。在獲得書麵同意後,參與者被分配到一個研究編號,並提供基線問卷和基線睡眠日記。研究人員和受試者商定受試者開始服用研究藥物的日期* (t=第1周),並提供個性化的時間表。最後,參與者填寫一張他/她使用的非處方藥(OTC)清單。
實驗用藥:對參與者的藥理學資格(排除標準10)進行最後的雙重檢查,根據所聲明的使用OTC藥物和參與者所在社區藥房當前使用的處方藥清單,例如,由全科醫生尚未認識的專家開具的藥物。如果與研究藥物發生相關的藥物-藥物相互作用,則排除受試者。
*全科醫生負責研究藥物處方。當患者在全科醫生會診後1個月後希望開始研究藥物時,研究人員請全科醫生在開始前一周再次檢查醫療納入和排除標準(1 - 15)。
隨機和盲
研究參與者將被隨機分配到三個研究組中的一個:阿米替林、米氮平或安慰劑(比例為1:1:1),采用隨機序列組(每組3個)。隨機分組根據睡眠問題的主要類型(例如,頻繁醒來vs過早醒來)進行分層,以解釋潛在的效應修正。由實驗藥房的一名藥劑師運行的計算機算法將進行隨機分配,而該藥劑師沒有參與這項研究。研究團隊、全科醫生和參與者以及參與者所在的社區藥房對治療分配是盲目的。參與者的社區藥房被告知參與情況,以確保檢查新處方中阿米替林或米氮平的潛在藥物相互作用。本研究藥物不包含任何關於分配的參考文獻。根據一項揭盲議定書,隻有在出於醫療理由需要揭盲的情況下,也就是說,考慮到該參與者和/或其他參與者的安全,反應的性質需要確定其與研究藥物的可能關係時,才會對個別參與者的治療進行揭盲。一名藥劑師24小時待命,隨時為患者緊急開盲。主效應分析將以一種盲目的方式進行。
研究藥物
研究藥物的生產和處理將按照ICH-GCP進行。32外觀相同的圓形白色薄膜片含有阿米替林10mg,米氮平7.5 mg或安慰劑,由荷蘭歐德貝耶蘭Tiofarma BV生產。添加苯甲酸甲地那銨後,安慰劑的味道略苦。研究藥物由實驗藥房提供給參與者。參與者被要求通過郵件(免費)將剩餘的研究藥物返回到實驗藥房,以便計數和隨後的銷毀。
幹預
試驗性治療包括16周阿米替林(1-2片10 mg)或米氮平(1-2片7.5 mg)或相同的安慰劑(1-2片)。所有參與者在睡前2小時至30分鍾開始每晚一片藥片(t=第1周)。參與者和全科醫生被指導在第3周(第2 - 4周)和第14周(第13-14周)預先計劃谘詢,以評估對睡眠的影響和治療的副作用。在第3周(第2-4周),全科醫生和參與者可以決定切換到結構雙劑量方案(每晚兩片直到第14周)。在第14周(13-14周)的會診中,全科醫生提醒參與者在16周後停止研究藥物,並在最後2周(第15和16周)使用單劑量,以防出現雙劑量。指導全科醫生告知參與者停止研究藥物可能產生的短期反彈效應。如果與全科醫生同意,雙劑量方案的參與者可以在較早的時間點恢複單劑量方案。參與者被告知,除了預先計劃的谘詢外,他們還可以不受任何限製地谘詢他們的全科醫生(因為他們的睡眠問題或其他原因)。
測量的結果和時間
治療效果的衡量將基於患者報告的與睡眠和日間功能相關的預後指標(PROMs)。問卷(Q)在五個時間點在線或書麵填寫:基線時、第6周和第12周治療期間、第20周和第52周隨訪期間。在基線、第6周和第20周前瞻性地保持紙筆睡眠日記1周。在可用的情況下使用經過驗證的問卷。睡眠日記和荷蘭語的睡眠相關問卷的翻譯是基於van der Zweerde使用的等.36為了促進參與者完成後續調查,對於未回複問卷的參與者,將發送提醒信息,參與者完成Q1-4和Q5將分別獲得30歐元和10歐元的獎勵。表1提供感興趣的結果及其時機的概述。
額外的測量
其他測量包括返回實驗藥房的片劑的藥片數和來自全科電子醫療記錄的相關數據。這包括谘詢(谘詢的頻率和原因、身體和精神健康疾病的診斷)和知情同意日期前後1年的睡眠藥物處方。beplay体育相关新闻這些信息將用於評估照舊護理和評估幹預措施,例如,額外的失眠治療如睡眠藥物處方的效果。
主要的結果
主要研究結果是用失眠嚴重程度指數(ISI)衡量失眠的嚴重程度(在治療6周時與基線時相比)。37ISI是一份包含7個項目的自評問卷,采用李克特5分製(0=完全沒有,4=極度嚴重),得分從0到28分,得分越高表示失眠越嚴重。ISI評估失眠症的性質、嚴重程度和影響,根據患者所感知的失眠的夜間和白天方麵。ISI被驗證為在一般人群中識別臨床顯著失眠患者38在初級保健人群中也是如此。39它被驗證為在線使用。40它具有足夠的內部一致性,並對更改做出響應。38ISI也是失眠試驗結果測量的推薦工具。41
二次結果
次要結果包括自我報告的睡眠質量和由睡眠指數、日間功能和症狀(疲勞、焦慮和抑鬱)、安全性和治療評價(副作用、戒斷症狀、治療滿意度和依從性)以及護理消耗(基於自我報告和醫療記錄)量化的睡眠。疲勞是失眠最常見的白天後果之一。情緒症狀通常也與失眠有關。為了評估患者對整體治療效果的自我評估,將使用全局變化率(視覺模擬量表評分)。最後,我們添加了一個更個性化的方法,以評估治療效果對參與者自己的前3個白天失眠後果(基於GSII的問卷調查)。42
其他研究參數
其他研究參數包括:性別、年齡、體長和體重、最高教育水平、目前工作狀況、吸煙狀況、飲酒情況。
患者和公眾的參與
研究程序、患者信息和結果測量與失眠患者小組討論,分別測試可行性、可理解性和完整性和相關性。研究結果亦會提交給失眠患者,並與他們討論,以加強研究結果的實施。
樣本大小的計算
計算6周主要結局(ISI)的樣本量,假設冪為80%,α為0.05,研究退出率為25%,考慮到全科患者的聚類,額外增加10%。因此,每組43-52例患者,共計156名參與者。對不同睡眠質量測量的效果大小(積極治療組從52%到96%不等,安慰劑組從20%到40%不等)從資助時發表的五項研究中獲得,這些研究在不同的患者樣本中研究低劑量埃斯米氮平(最多4.5 mg/天)、阿米替林(最多30 mg/天)或米氮平(15 mg/天),持續2到13周,即原發性失眠、纖維肌痛、強直性脊柱炎、慢性心理生理性失眠與安慰劑對照或不對照。31日43-45以上使用的研究退出(治療中斷)率(25%)是根據12周至6個月的失眠藥物治療研究報告的平均率估計的。27 43 46 47使用ISI的SD評分,來自另一個在荷蘭失眠患者群體中進行的試驗14在SD 3.5和5.5之間,我們這個樣本量的最小可檢測變化將是ISI評分的3.5 - 4分。
數據分析
根據CONSORT指南,33 34將報告所有參與者流程。將提供基線數據以及治療依從性的數據。標準化問卷將根據他們的手冊或其他定製(公布)方法進行分析。阿米替林和米氮平治療將在單獨的分析中與安慰劑進行比較。
主效應分析,在6周時測試研究藥物與安慰劑的療效,將包括所有參與者(意向治療分析),並以盲法進行。將進行線性混合模型分析,並適當處理缺失數據,例如通過多重imputation。兩個研究用藥組與安慰劑組之間的差異將用效應大小來表示,並計算一個Cohen’SD,它可以被解釋為每個研究治療組分別比安慰劑組得分高的SD數。48此外,兩組藥物治療組將與安慰劑組進行比較,以確定改善或恢複的參與者百分比。ISI評分為10分或更低的將被視為康複。改善定義為ISI變化評分>7。38這些信息將用於計算相對風險和需要治療的人數。采用logistic回歸模型將副作用報告率、戒斷和反彈症狀以及治療評價項目與安慰劑進行比較。除了主要效果分析外,還將進行一些次要(探索性)分析,例如,按方案分析和按劑量分析。
數據管理和保密
根據荷蘭隱私立法和ICH-GCP法規,在整個試驗過程中和試驗結束後,將確保患者信息的保密性。32問卷將通過結構數據庫(Castor電子數據捕獲)進行收集、輸入和數字化存儲。原始的紙質睡眠日記和紙質問卷將以一種不能直接追溯到參與者身份的方式進行編碼。數據將保存15年,在此期間之後,關鍵文件將被銷毀。
患者安全和監測
醫學倫理委員會VUmc批準了該研究方案,並將DREAMING列為一項低風險研究:在研究人群中以低劑量(即低於抗抑鬱藥物療效的劑量)使用知名仿製藥,該研究人群反映了目前的超說明書目標人群。阿姆斯特丹UMC所在地VUmc臨床研究局將對VUmc所在地和參與地點的研究活動進行現場監測,即一般實踐。由於本試驗被認為是一項低風險研究,因此不需要成立數據安全監測委員會/安全委員會。從幹預開始(即開始研究藥物)到服用最後一劑研究藥物後28天(即停止日期),全科醫生對不良事件(ae)進行監測。指導全科醫生報告嚴重的AEs (sae)32以及嚴重的不良事件(即,嚴重或醫學上有重大意義,需要按照不良事件通用術語標準(CTCAE, III級)進行醫療幹預),並可能與協調研究人員的幹預相關的不良事件。協調研究人員將在治療期間(約第6周)和最後一劑研究藥物後約30天給參與者打電話,對全科醫生未知的事件進行最後檢查。所有SAE和疑似意外嚴重不良反應(SUSARs)將根據我們的安全報告協議報告給經認證的醫學倫理委員會。
潛在的挑戰和限製
dreams是一項隨機安慰劑對照試驗,在50多個綜合實踐中進行。它的實用設計有利於結果的外部普遍性。然而,由於藥物試驗(甚至低風險)的嚴格規定,一些實際障礙需要克服,而一般實踐沒有被用作正式的“參與研究地點”。該研究的成功進一步依賴於將患者納入全科谘詢,眾所周知,這是非常困難的。49在這個特定的案例中,一個特殊的困難是所研究的治療方法在試驗中並不完全可用,而且在常規護理中也超出了標簽。將開展一些活動,如提醒和支持,以促進患者的包容。
在門診參與者中進行務實藥物試驗的另一個後果是,藥物依從性監測是基於自我報告和返回的藥片數量。這將在治療分析的每個方案和意圖中考慮到。綜上所述,CBT-I仍是治療失眠障礙的首選治療方法,符合國際標準。在非藥物治療效果不充分且希望使用睡眠藥物的情況下,本研究將回答低劑量阿米替林和米氮平是否在短期和長期內有效替代BZRAs治療失眠和日間功能。
道德和傳播
阿姆斯特丹自由大學醫療中心醫學倫理委員會批準了該試驗(注冊號為2017.630a),並在荷蘭試驗登記處(NTR7449)注冊。對研究方案的任何修改都將在實施前提交醫學倫理審查。這項試驗的結果將發表在同行評審的科學期刊上,並在相關學術會議和向關鍵利益攸關方展示。
倫理語句
病人同意發表
致謝
我們感謝John Kaal, Marcel Smits和Anneke van Schaik
研究方案製定中的臨床投入。
參考文獻
腳注
貢獻者PS構想了這項研究。所有作者(MHB, JGH, AvS, HEvdH和PS)從多學科的角度(分別是全科、臨床藥理學和藥學、臨床心理學、全科和流行病學)對試驗設計做出了貢獻。MHB起草了手稿,是協調研究人員,將進行統計分析。所有作者都認可了最終稿。
相互競爭的利益沒有宣布。
患者和公眾的參與患者和/或公眾參與了本研究的設計、實施、報告或傳播計劃。有關更多細節,請參閱方法部分。
來源和同行評審不是委托;外部同行評議。
請求的權限
如果您希望重用這篇文章的任何部分或全部,請使用下麵的鏈接,它將帶您訪問版權清除中心的RightsLink服務。您將能夠快速獲得價格和以多種不同方式重用內容的即時許可。


