條文本
摘要
目標評價尼泊爾偽劣藥品召回的模式。
設置我們分析了尼泊爾藥品管理局(DDA)發布的藥品召回通知,並係統審查了2010年1月至2020年12月期間同行評審的研究文章。
參與者這項研究沒有包括人類參與者。然而,數據是從藥監局發布的72份藥品召回通知和四篇研究論文中收集的。
結果在報告所述期間,共有346種藥品被召回。在尼泊爾,被召回的藥品數量在過去十年中顯著增加。召回次數最多的藥物是抗微生物藥物,其次是胃腸道藥物、維生素和補充劑以及止痛和姑息藥物等。進口召回藥品數量(42.2%)略高於國產召回藥品數量(40.7%)。被召回的藥品中,62%是不合格的,11%是偽造的,剩下的27%沒有在DDA注冊。同樣,現代藥品被召回的數量(62%)高於傳統藥品(35%)。用於減少COVID-19傳播的洗手液在2020年被召回的藥品名單中占了很大比例。這些消毒劑大多含有大量甲醇(高達75% v/v),而不是適當數量的乙基或異丙醇。同行評議的研究論文報告了標簽、未注冊藥物和藥物在幾項實驗室檢測中失敗的問題。
結論我們的分析顯示,尼泊爾召回不合格和偽造藥品的數量正在增加。由於本文的召回數據不包括檢測的樣本數量和收集的樣本位置,建議進行更多的研究來了解尼泊爾劣質和偽造藥物的流行情況。
- 公共衛生
- 新型冠狀病毒肺炎
- 衛生經濟學
數據可用性聲明
資料應合理要求提供。所有與研究相關的數據都包含在文章中或作為補充信息上傳。作者編輯和策劃的原始數據將提供給通信作者合理的要求。
這是一篇開放獲取的文章,按照創作共用署名非商業性(CC BY-NC 4.0)許可發布,該許可允許其他人以非商業性的方式發布、混編、改編、構建本作品,並以不同的條款授權他們的衍生作品,前提是原創作品被正確引用,給予適當的榮譽,任何更改都被注明,且使用是非商業性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
來自Altmetric.com的統計
本研究的優勢和局限性
這是第一個評估尼泊爾藥品召回模式的研究。
綜合分析尼泊爾藥監局2010年1月至2020年12月發布的藥品召回通知。
還包括對2010年至2020年同行評審出版物的係統審查,這些出版物報告了尼泊爾的劣質藥品。
不包括測試樣本數目、收集樣本地點及召回通知的影響。
由於我們關注的是召回藥品的模式,它沒有報告過去十年中低質量藥品的比率。
簡介
醫藥產品對於治療、預防和拯救全球數百萬人的生命至關重要。1安全、有效、質量好。此類產品應由認可的醫生處方並合理使用。2然而,不符合監管標準和質量的藥品威脅著當今和未來人口的健康。這些產品可能是不合格的、低質量的或偽造的。不合格或假藥除了增加人們的經濟和社會負擔外,還可能導致耐藥性,使患者的生命處於危險之中。3.這種不合格和偽造產品在市場上流通有幾個原因,例如缺乏獲得負擔得起、質量好、安全和有效的醫療產品的途徑和良好的治理,以及保健設施和藥品銷售點的不良道德做法。製造、質量控製、分銷和測試方麵有限的技術能力也是造成這一問題的原因。4個5
小澤等在2018年的一項元分析中估計,全球約10.5%的藥物不是不合格就是偽造的。與高收入國家相比,低收入和中等收入國家的低質量藥品患病率更高(13.6%)。據估計,非洲約有18.7%的藥品質量低劣,亞洲約有13.7%。偽劣藥品最多的是抗瘧藥(19.1%)。3.
尼泊爾是最不發達的國家之一6它與印度和中國接壤,邊境開放,但監管不力。這兩個國家被認為是在全球市場上流通的偽劣藥品的主要生產國。42019年,尼泊爾醫療產品的國內市場估計為700億尼泊爾盧比,其中包括藥品(360億)、原材料和手術設備。7藥品管理局(DDA)授權所有藥品在尼泊爾的分銷,包括生產、分銷、出口和進口。尼泊爾的DDA相當於美國食品和藥物管理局(FDA),負責防止藥物和相關藥物的誤用或濫用。8過去很少有研究表明在尼泊爾市場上流通著不合格、假冒和未經登記的藥品。9 - 11如果藥品不符合《藥品法案2035 B.S.》中規定的任何要求,尼泊爾藥品管理局將召回已上市藥品8當發現不合格、偽造和未注冊的藥品事件時,該局會發出公眾警報和警告。對藥品警報、監管召回和公司主導的召回模式的分析有助於理解導致劣質藥品供應的主要問題,並設計適當的行動來緩解問題。12日13對醫療產品召回和警報的分析來自少數國家,如英國12還有沙特阿拉伯,14被召回藥品的數量顯著增加。
在本研究中,我們通過分析尼泊爾藥品管理局發布的藥品召回通知,報告了尼泊爾劣質藥品的召回模式。分析了低質藥品的時間趨勢、藥品種類和劑型、藥品產地和生產廠家以及召回原因。我們還回顧了報道藥物質量數據的研究出版物。
方法
我們分析了尼泊爾藥監局在2010年1月至2020年12月發布的藥品召回通知。發展局在其刊物、網站及報章刊登有關公告(https://dda.gov.np/).我們提取了召回通知上提供的所有信息,如品牌名稱、劑型、批號、生產日期、有效期、召回日期、不合格原因和製造商信息。我們使用尼泊爾《2016年國家基本藥物清單》將召回藥物分為基本藥物和非基本藥物15以及世衛組織的定義,以識別不合格、偽造和未注冊的藥物。16根據世界衛生組織的定義,不合格藥品是經批準的醫療產品,但不符合質量標準或規格,或兩者都不符合。同樣,假藥是指謊報其身份、成分或來源的醫療產品。17未通過溶出度試驗、活性成分試驗、微生物試驗、滲漏試驗、易碎性試驗、物理外觀、真菌計數、重量變化、顆粒物試驗、均勻性試驗、崩解試驗和pH試驗等不符合藥典規定的藥品歸為不合格品。同樣,含有雜質、活性成分不應存在、未經批準有價簽、沒有產品規格的藥品也被歸類為假冒藥品。因未在尼泊爾DDA注冊而被召回的藥品屬於未注冊類別。未經注冊的藥物不經尼泊爾藥品監督管理局的評估和/或批準。基於每個非阿育吠陀藥物產品的品牌名稱,我們確定了它們的通用名稱,然後根據它們的治療特性將它們分為不同的組。
除了召回通知外,我們還係統地查閱了已發表的研究著作,發現尼泊爾市場有低質藥品的報道。我們專門從PubMed(2010-2020)、Web of Science(2010-2020)、SpringerLink(2010-2020)和穀歌Scholar(2010-2020)等電子數據庫中搜索了同行評議的研究文章。我們使用以下搜索詞配合布爾搜索詞(“或”、“與”)來識別相關文章:“假冒的”、“不合格的”、“偽造的”、“假冒的”、“假藥的”、“不受監管的藥物”、“未注冊的”或“欺詐的”;與' drug ', ' medicine '或' pharmaceutical '組合;“尼泊爾*”。在穀歌Scholar中使用了相同的搜索詞,但我們使用的不是“尼泊爾*”,而是“intitle:Nepal”。通過標題和摘要對文章進行人工篩選和評估,其納入標準包括:發表日期(2010-2020年)、文章發表語言(英語)、文章應包含關於假藥/假藥/假藥/劣藥流行率的數據/信息以及進行實驗/研究的地點。不符合納入標準的文章被排除在外。同樣被排除的還有意見文章、信件、筆記、會議論文、書籍章節、社論或評論,或沒有摘要的文章,或含有與動物有關的假藥或劣藥的文章。
文中給出了搜索程序流程圖圖1.最初,我們在PubMed、SpringerLink、Web of Science和穀歌Scholar四個不同的數據庫中搜索文獻,確定了467篇期刊文章。我們刪除了13篇重複的文章,使文章數量達到454篇。通過篩選這些文章的標題和摘要,我們刪除了439篇文章,我們隻考慮了15篇文章在下一步(看到在線補充表SI).我們閱讀了這些文章的全文,並排除了11篇文章,因為它們不符合納入標準。最後,四篇文章9 - 11 18含有尼泊爾市場上不合格、偽造和未注冊藥品流行率的主要信息。
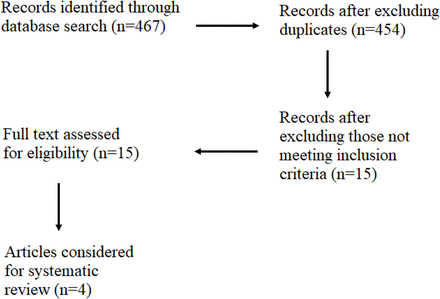
研究論文檢索程序流程圖。
統計分析的數據,如χ2采用R V.1.4.1106進行了Fisher確切檢驗和簡單線性回歸。
病人與公眾參與
患者或公眾未參與本研究的設計、實施、報告和傳播計劃。
結果
我們分析了2010-2020年期間的召回藥品。在此期間,尼泊爾藥品監督管理局召回了346種藥品。尼泊爾召回的低質量藥品數量在過去十年顯著增加(圖2一個,線性回歸,p值<0.05,調整R2值= 0.335)。我們發現2010年隻有一種藥品被召回。該產品是一種乳酸溶液,通常用於液體複蘇。由於沒有通過無菌檢測,該溶液被從尼泊爾市場召回。2012年沒有召回。2018年是藥品召回數量最多的一年(123個產品,見圖2一個).2020年被召回的產品有46種,其中大部分是洗手液。被召回的藥品來自96家製造商,大部分來自尼泊爾和印度,少數來自澳大利亞、孟加拉國和中國。91種被召回藥品的生產商不詳。被召回的藥品中進口藥品(153種)的數量顯著高於國產藥品(141種)(雙麵Fisher確切檢驗,p值<0.001)。被召回的進口產品大多在印度製造(97%,圖2 b)以及來自澳大利亞、孟加拉國和中國的毒品。52個被召回藥品的原產國未被確定。
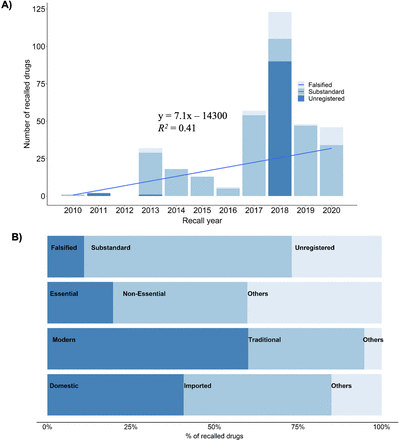
(A)尼泊爾藥品召回的時間趨勢。(B)不同類別的藥品在被召回名單中的比例。
被召回藥品中60% (n=346)為現代或對抗療法(208),35%為傳統或阿育吠陀(120)(圖2 b).雙麵Fisher確切檢驗顯示,現代製藥產品被召回的數量顯著增加(p值<0.001)。27%的被召回藥品未在尼泊爾藥品監督管理局注冊,這表明它們未被授權在尼泊爾分銷和銷售。同樣,20%的被召回藥物(大部分是對抗療法藥物)被列為基本藥物。40%的被召回藥物是非必要的對抗療法藥物(p值<0.001),40%為阿育吠陀藥物。基本藥品通過政府保健中心免費發放15隻有對抗療法藥物被列為必需藥物。大部分被召回的藥品是不合格的(62%),其次是未注冊的(27%)和偽造的(11%)圖2 b).我們發現這三類人的回憶模式有顯著性差異(單向χ2檢驗,p值<0.001,χ2= 142.31, df = 2)。
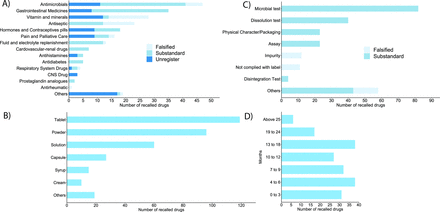
被召回最多的前10種藥物是抗菌素(13.6%),其次是胃腸道藥物(10.1%)、維生素和礦物質(8.1%)、防腐劑(6.6)、激素和避孕藥具(5.2%)、疼痛和姑息治療藥物(4.6)、補充液體和電解質的藥物(3.7%)、心血管和腎髒藥物(2.0%)、抗糖尿病藥物(1.4%)和抗組胺藥物(1.4%)(見圖3一).其餘召回藥物為中樞神經係統藥物、呼吸係統藥物、前列腺素類似物和抗風濕藥物。由於沒有足夠的信息,19種藥物沒有被歸為上述任何一類,而是被標記為“其他”。阿育吠陀藥物不包括在這一分類中。
(A)基於治療方法的被召回藥品類別,(B)被召回藥品的劑型類型,(C)被召回藥品的主要原因,(D)被召回藥品在召回後的自我壽命(以月為單位)。
DDA為每一種被召回的藥品提供了原因。大量藥品(26.8%)因未在DDA注冊而被召回。在被召回的注冊藥品中,最常見的原因是不符合微生物檢測(23.7%),其次是溶出度檢測(11.5%)、活性成分定量檢測(6.6%)和物理特性和包裝檢測(6.6%)。11個產品不符合標簽要求,12個產品含有一種或多種雜質。少數被歸類為“其他”的樣品因未能通過鑒定測試而被召回,並在膳食補充劑中含有有效成分(見圖3 b).被召回最多的劑型為片劑,其次為粉末狀、溶液狀、膠囊狀、糖漿/混懸劑和乳膏/軟膏。部分產品的劑型無法辨認,屬“其他”類(圖3 c).被召回藥品的保質期由少於3個月(16.4%)至超過2年不等(圖3 d).
研究論文中報道的低質量藥物
如方法部分所述,隻有四篇研究文章被納入詳細分析。Jha報道的其中一篇文章18評估了尼泊爾21個區62個公共衛生保健設施提供的基本藥物的質量。作者對20種不同的基本藥物仿製藥244批次進行了檢測,發現有37批次未達到藥典標準。質量不合格藥品包括尼泊爾政府提供的藥品(62.2%)和從當地藥店購買的藥品(37.8%)。失敗的藥物包括抗生素、補劑、抗糖尿病藥等。
在標簽上提供必要的信息是另一個主要問題。2017年在Chitwan被檢查的37家尼泊爾製藥公司的759種藥品中,大多數缺少標簽上至少一項關鍵信息,如藥品數量、藥典名稱、製藥行業序列號、價目表、藥品分類和尼泊爾語信息。10報告顯示,84%的藥品標簽沒有提供使用說明。同樣,加德滿都90%的藥品樣品(n=40)不符合現有的標簽監管要求,42.5%的品牌沒有標明藥典標準。9該研究還顯示,40%的國產品牌和28%的進口品牌在實驗室分析中不符合國家標準。在本次研究中,平均有32.5%的樣品被發現質量不合格。另一項研究利用滾雪球抽樣方法和衛生行動國際亞太工具包對尼泊爾20家零售藥店的未注冊固定劑量聯合藥物的可得性和合理性進行了評估。在尼泊爾的5個主要城市發現了41種未注冊的固定劑量抗炎/鎮痛/解熱藥物組合。監管部門應啟動嚴格的監控和適當的監管機製,禁止使用未經注冊和不合理的fdc。11
討論
低質量藥品或相關產品由生產公司自願或根據國家或國際藥品監管機構的命令從市場上召回。19全球已經報道了許多劣質藥品的召回事件。20.例如,強生公司在2013年召回了20萬瓶液體布洛芬,原因是可能被塑料顆粒汙染。2012年,美國食品和藥物管理局召回了新英格蘭複合中心生產的受汙染的小瓶皮質類固醇藥物。21一項針對英國藥品召回的分析顯示,從2001年到2011年,有缺陷的藥品增加了10倍,主要是由於汙染和包裝問題。12同樣,沙特阿拉伯藥品管理局報告的藥品召回數量從2010年到2018年增加了6倍,其中最常見的召回藥物是抗高血壓藥物和抗生素,原因是汙染和不符合製造商規格的問題。14
我們的分析顯示,尼泊爾召回藥品的總體趨勢是增加的。從2010年的單一藥品召回到2018年的最高數量(123起)。今年被召回的大部分藥品(90種)都是因為沒有在DDA注冊。這表明,未注冊藥物在市場上流通是尼泊爾的一個嚴重問題,這可能是與印度開放和不受管製的邊界造成的。
對抗療法和阿育吠陀醫學在尼泊爾廣泛使用。對抗療法藥物是合成的現代藥物,而阿育吠陀藥物是使用自然療法來改善健康或治療疾病的傳統藥物。除了主要從印度進口外,這兩種藥物都是在尼泊爾進行商業生產的。在尼泊爾有兩組阿育吠陀藥物的製造商。第一類是注冊公司,通過注冊商店包裝銷售產品。其次,阿育吠陀藥物是由未在DDA注冊的個人或小企業主生產的,他們通過挨家挨戶的服務和個人網絡在街頭銷售他們的阿育吠陀產品。我們發現對抗療法和阿育吠陀藥物都因不符合政府標準而被召回。阿育吠陀醫學在尼泊爾社區中被顯著使用,有時,它們與對抗療法藥物同時使用。22在世界各地,人們對傳統醫學的研究越來越感興趣。23然而,這一領域仍然缺乏質量研究和標準,缺乏嚴格的監管環境。
世衛組織將基本藥物定義為滿足人口優先衛生保健需求的藥物。24尼泊爾於公元1986年通過了基本藥物的概念,以增加每個人獲得基本藥物的機會。尼泊爾《國家基本藥物清單》中藥物選擇的主要標準是與公共衛生的相關性、有效性、安全性、成本效益和藥物的可及性。尼泊爾2016年的《國家藥品目錄》包含359種藥物,比2011年的《國家藥品目錄》多86種藥物。15將一種藥品列入國家藥品名錄時采用了以下標準:在尼泊爾獲得批準和許可,與造成公共衛生問題的疾病相關,已證實的療效和安全性,符合尼泊爾的標準治療指南,在儲存條件下穩定,具有成本效益和可獲得性。然而,在某些情況下,一些藥物被排除在國家藥品目錄之外:如果有效率更高、安全性更高、成本更低的藥物,與公共衛生疾病負擔無關、具有抗菌素耐藥性、有濫用和誤用可能的藥物,出於安全考慮在尼泊爾被禁止的藥物。15我們的研究表明,一些被召回的對抗療法藥物是基本藥物。傑哈18表明存在大量不合格基本藥物,其中大部分由尼泊爾政府購買。尼泊爾通過政府醫院、保健中心和保健站免費提供治療各種疾病的基本藥品。基本藥物質量差可能對公共衛生產生嚴重影響。由於DDA召回的藥品中有很大一部分包括尼泊爾政府分發的基本藥品,因此有足夠的空間來改進采購做法和升級尼泊爾儲存和分發藥品的衛生設施。在一項研究中25調查了尼泊爾的采購做法,據報道,尼泊爾的大多數醫院藥房使用昂貴的直接采購模式來采購藥品。他們根據醫生的處方來選擇特定的品牌,這可能受到製藥公司營銷策略的影響。大多數醫院藥房隻采購注冊藥品,少數報告稱通過未經批準的供應鏈采購未注冊藥品。並非所有藥店在藥品采購過程中都遵守巴塞爾聲明。這類藥店可能需要提高認識和培訓,以便充分采用國家和國際政策的規章,以提高獲得高質量藥品的能力。
在召回組中,抗菌藥物組召回事件發生頻率最高。Acharya和威爾遜26強調尼泊爾的抗菌素耐藥性問題是公共衛生狀況惡化的警鍾。劑量過低或製造不良的抗生素藥物增加了耐藥性的機會。27大多數被召回的治療類藥物,如維生素和礦物質、非甾體類消炎藥、其他解熱和止痛劑、防腐劑、液體和電解質補充用品以及其他非處方藥物,無需處方即可從藥店購買。這類藥物可能對服用它們的患者構成重大威脅。28很少有抗糖尿病藥物也被召回。這些藥物的消費可能增加大血管和微血管並發症的發生率,由於血糖控製的損害。29
我們的研究表明,部分藥品被召回的原因是未能通過各種實驗室測試,如微生物測試、化驗、含量均勻性測試、重量變化、雜質測試、溶出度測試、易碎性測試以及鑒定和無菌測試。許多此類故障可能與製造過程中質量控製措施不充分、運輸和儲存程序不當以及其他物流問題有關。17
Jha指出,在接受檢查的62個衛生設施中,隻有13%遵循了關於光、熱和濕度的藥品儲存指南。18保持溫度和濕度在規定的範圍內是必要的,因為它在藥物降解中起著重要作用。另一個原因是未能遵守聲明和不正確的標簽。DDA法規要求對已上市藥品進行適當的標簽,以確保患者安全。因此,應該鼓勵藥品分析人員和藥品監管人員對假冒的可能性保持警惕。他們應該進行適當的分析,包括化學、物理、包裝檢查和認證工作,以確保藥品到達最終用戶的質量和安全。30.
尼泊爾國內生產和進口的藥品應獲得DDA的注冊許可證。8盡管如此,我們在檢查過程中發現大量未注冊藥品被召回。藥品供應商、批發商甚至零售商應確保他們所經營的藥品在國家監管機構正式注冊,以確保隻有安全有效的藥品才能到達患者手中。此外,監管機構應該進行上市後監督,以改善這種情況。尼泊爾未注冊的醫療產品可能在印度注冊,也可能沒有。由於尼泊爾與印度邊界開放,但監管不力,在印度注冊的藥品也很容易在尼泊爾市場銷售,特別是在邊境地區。我們發現,近一半的被召回藥品是從印度進口的。印度是假藥生產的主要國家,全世界35%的假藥生產來自印度境內。31
2019冠狀病毒病大流行導致偽劣醫療產品激增,包括藥品、口罩、消毒劑、診斷試劑和疫苗以及其他基本醫療產品。32在突發事件期間,偽造醫療產品的猖獗流通在曆史上時有發生。32假冒的口罩和口罩對醫護人員構成了額外的風險。332020年3月至5月期間,在喀麥隆、剛果和尼日爾繳獲了偽造氯喹。氯喹被宣布為治療新冠肺炎的藥物,引發了爭議。34美國食品和藥物管理局在新冠肺炎初期發現了近1300種欺詐產品。35尼泊爾DDA最近修訂了即時洗手液標準,以禁止銷售不合格、偽造和未注冊的洗手液。36在2020年9月至11月期間,DDA發布了19款不符合標準指南的洗手液的召回通知。一些消毒劑被發現含有甲醇,而不是乙醇和異丙醇。甲醇毒性很大。使用含甲醇的洗手液可能引起透皮吸收,增加全身毒性的風險。37麵對新冠肺炎疫情,洗手液等藥品的需求增加,促進了電子商務的增長。近年來,藥品的網上銷售在尼泊爾剛剛開始。世衛組織報告說,通過互聯網購買的藥物中有60%可能是假冒或不合格的,而從隱藏其實際地址的網站購買的藥物中有50%以上被發現是劣質藥物。38尼泊爾的管理機構應特別注意這種在尼泊爾做生意的新方法,以保護人民不消費低質量和偽造的醫療產品。網上藥店、不受監管的網站和商業社交媒體平台的不可阻擋的增長,可能會助長未經批準、次效、假冒、過期或非法藥品和沒有有效處方的處方藥的分發。39
監管機構的召回和警告是重要的一步,但需要采取更多的行動,以充分了解市場上的不合格和假藥流通及其潛在影響。諾頓和Akgul13認為免費的藥品警示和召回不足以評估藥品質量。研究人員建議監管機構公布更多信息,如被召回包裝的確切數量、收集和檢測的樣品數量、進行的檢測和結果等。此外,在樣本量、設計方法的一致性、報告背景因素方麵,不合格和虛假(SF)流行研究的抽樣方法是可變的,導致各研究之間的比較不可靠。40因此,需要製定一套檢測和報告標準議定書、全球法律框架和不合格和偽造藥品的監測係統。41這可能有助於比較不同國家的結果,相互理解,並在全球範圍內製定更好的政策幹預措施。13
結論
在這篇論文中,我們提出了一個詳細的模式,低質量和假藥流通尼泊爾在過去十年使用召回通知。我們發現,被召回藥品的數量顯著增加。與以前的研究類似,這可能是由於DDA加強了監督,或者是市場上不合格、偽造和未注冊藥品的實際數量增加。12然而,我們的分析不足以確定召回藥品增加的確切原因。與全球趨勢一樣,尼泊爾召回最多的藥品是抗菌藥物。所使用的召回通知書並沒有提供收集樣本數目及樣本收集地點的資料。因此,我們的分析沒有報告低質量藥物的發生率或流行率。由於無法獲得樣品收集地點,因此不可能了解尼泊爾最容易獲得低質量藥品的地區。因此,需要進行更多的研究,以了解尼泊爾不同地區的劣質和假藥的流行情況。我們建議對製藥行業建立更嚴格的監管體係和實施措施,並加強上市後監督。
數據可用性聲明
資料應合理要求提供。所有與研究相關的數據都包含在文章中或作為補充信息上傳。作者編輯和策劃的原始數據將提供給通信作者合理的要求。
倫理語句
病人同意發表
倫理批準
不適用。
參考文獻
補充材料
-
補充數據
這個網絡僅文件已由BMJ出版集團從作者提供的電子文件生產(s),並沒有編輯的內容。
腳注
推特@SabitaT25927567, @girib71
貢獻者BG貢獻了概念和研究設計,數據分析和稿件修改。AN, MB負責數據收集、分析和初稿。ST對數據收集做出了貢獻。BG作為擔保人負責整體內容。所有作者都認可了手稿的最終版本。
資金作者們還沒有從任何公共、商業或非營利部門的資助機構為這項研究宣布具體的資助。
相互競爭的利益沒有宣布。
患者和公眾的參與患者和/或公眾未參與本研究的設計、實施、報告或傳播計劃。
來源和同行評審不是委托;外部同行評議。
補充材料本內容由作者提供。它沒有經過BMJ出版集團有限公司(BMJ)的審查,也可能沒有經過同行評審。討論的任何意見或建議僅僅是那些作者(s)和不被BMJ認可。BMJ放棄從放在內容上的任何依賴產生的所有責任和責任。如果內容包含任何翻譯材料,BMJ不保證翻譯的準確性和可靠性(包括但不限於當地法規、臨床指南、術語、藥品名稱和藥物劑量),並且不對翻譯和改編或其他原因引起的任何錯誤和/或遺漏負責。