條文本
摘要
客觀的評估低危婦女常規服用阿司匹林的可行性和可接受性,並與篩查試驗表明阿司匹林預防先兆子癇和胎兒生長受限進行比較。
設計多中心開放標簽可行性隨機對照試驗。
設置愛爾蘭都柏林的兩所三級婦產醫院。
參與者546名低風險未生育婦女完成了這項研究。
幹預措施婦女接受計算機隨機分組:第一組從11周到36周常規服用阿司匹林75毫克;2組不服用阿司匹林;基於胎兒醫學基金會篩查試驗的3組阿司匹林。
主要和次要結果測量(1)同意參與的比例;(二)協議符合性;(3)妊娠早期可獲得子宮動脈多普勒的比例;(4)發布篩選結果所需的時間。次要結果包括子癇前期和小胎齡胎兒的發生率。
結果546例患者分為阿司匹林常規組(179例)、不服用阿司匹林組(183例)和篩查治療組(184例)。1054人中有546人(51.8%)接受了采訪。阿司匹林的平均依從率為90%。子宮動脈多普勒篩查率為98.4%(181/184),平均獲得篩查結果的時間為7.6(0 ~ 26)天。在服用阿司匹林的患者中,陰道斑點更多;n=29(15.1%),非阿司匹林n=28 (7.9%), OR 2.1 (95% CI 1.2至3.6)。產後出血>500 mL也較多;阿司匹林n=26(13.5%),不服用阿司匹林n=20 (5.6%), OR 2.6 (95% CI 1.4 ~ 4.8)。
結論低風險的未生育婦女在懷孕期間願意服用阿司匹林,並有較高的依從性。阿司匹林的使用與陰道出血的高發率有關。現在需要一項適當動力的隨機對照試驗來研究與篩查方法相比,通用低劑量阿司匹林在低風險妊娠中的有效性和安全性。
試驗注冊號碼ISRCTN (15191778);試。
- 子癇前期
- 篩選
- 阿斯匹林
- 可行性
- 低風險
這是一篇開放獲取的文章,按照創作共用署名非商業性(CC BY-NC 4.0)許可發布,該許可允許其他人以非商業性的方式發布、混編、改編、構建本作品,並以不同的條款授權他們的衍生作品,前提是原創作品被正確引用,給予適當的榮譽,任何更改都被注明,且使用是非商業性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
來自Altmetric.com的統計
本研究的優勢和局限性
穩健的多中心隨機對照試驗設計。
使用三種方法評估阿司匹林的依從性。
標準化的方法。
通過開放標簽設計可能引入報告偏差。
簡介
妊娠16周前使用低劑量阿司匹林可降低高危妊娠子癇前期的發生率。在這個階段服用75毫克的劑量,對低風險妊娠的療效尚不清楚。1 2隨著胎兒醫學基金會(FMF)等早期三個月子癇前期篩查試驗的出現,人們可以從11周開始預測子癇前期的風險。3.在國際上,對於篩查方法和哪些女性符合阿司匹林的使用標準,存在著相互矛盾的共識聲明。4應用FMF篩查試驗和提供低劑量阿司匹林篩查陽性婦女可顯著降低早發先兆子癇的發生率(4.3%阿司匹林vs 1.6%安慰劑,p=0.004),盡管算法的預測性能似乎在人群之間有所不同。5有人提出,FMF算法的性能優於國家健康和護理卓越研究所(NICE)和美國婦產科醫生學院推薦的方法。6盡管目前還沒有證據支持這一政策,但普遍開出低劑量阿司匹林可能更有效。7為了確定這一點,我們必須首先評估低風險女性是否願意在懷孕期間服用阿司匹林,以及在常規環境中進行全麵篩查是否現實。因此,這項多中心開放標簽可行性隨機對照試驗(RCT)的主要目的是評估孕婦在妊娠11周以上服用75 mg阿司匹林與篩查試驗指示的阿司匹林的可接受性和可行性。次要結局包括:(1)子癇前期;(2)胎齡小嬰兒;(3)早產;(4)新生兒重症監護;(5)胎盤早剝;(6)任何據報死亡的個案及;(7)婦女常規服用阿司匹林和試驗指示服用阿司匹林的可接受性,通過問卷調查進行評估。
方法
研究設計
這項開放標簽可行性多中心隨機對照試驗在兩家愛爾蘭三級婦產醫院進行,每年共分娩1.8萬例。目的是包括三個中心;但是,當地道德委員會對第三個中心的決定(後來核準)有延誤,這是為了研究日程的利益而被排除在外的。這次多中心隨機對照試驗的方案已經公布8並獲得了健康產品監管局和國家婦產醫院中央倫理委員會的前瞻性授權。該試驗得到了愛爾蘭圍產期健康研究委員會(HRB)和HRB母嬰臨床試驗網絡的支持,並進行了科學質量的外部同行評審。研究的資助方在研究設計、數據收集、數據分析、數據解釋或稿件撰寫中沒有任何作用。一個獨立的試驗指導委員會和數據監測委員會每季度開會一次,以監督試驗參與者的安全。
18歲以上、妊娠11 - 13+6周、單胎妊娠存活且不符合服用阿司匹林的主要子癇前期危險因素(慢性腎髒疾病;自身免疫性疾病,如係統性紅斑狼瘡、糖尿病和慢性高血壓)符合入選條件,因此在隨機選擇的產前預約診所招募。9在愛爾蘭,目前並不是常規的產科實踐,建議沒有NICE定義的上述子癇前期主要危險因素的婦女服用阿司匹林。9排除標準包括已經參加臨床試驗的參與者,招募時同時存在胎兒先天性異常或有阿司匹林過敏的參與者。所有參與者提供書麵知情同意,並由研究臨床醫生在妊娠前三個月產前預約訪問中招募。
隨機
研究人員或臨床醫生對受試者進行注冊和在線計算機隨機分組,分組為6至6個組:1組阿司匹林75 mg, 11至13+6周,每天一次,直到妊娠36周;2組不服用阿司匹林;3組阿司匹林取決於FMF篩查試驗的結果。未服用阿司匹林組的受試者接受常規的產前護理。隨機序列在研究開始前由非現場統計學家確定,並對評估者隱藏,評估者和參與者在在線選擇後同時看到組分配。
幹預
聯盟製藥公司免費提供腸溶Nu-Seals阿司匹林(乙酰水楊酸)75 mg,每日1次,夜間口服,妊娠11 - 36周,獨立於研究方案和分析。使用75毫克的劑量,因為這是目前英國和愛爾蘭對高危婦女的標準推薦劑量。9
主觀上通過患者日記卡和藥片計數(由臨床醫生和藥劑師檢查)評估阿司匹林依從性,客觀上通過評估尿中11-去羥基血栓素b2 (TxB2)的變化。在妊娠初期(服用阿司匹林前)和妊娠中期(服用阿司匹林後)之間TxB2水平的任何降低都表明該受試者在過去10天內攝入了阿司匹林。10
基線檢討及跟進
參與者接受了兩次預定的研究訪問,在研究招募時和在20-22周時(與他們同時進行的胎兒解剖掃描相一致),日記卡和阿司匹林片在妊娠36周時返回研究團隊。參與者在20-22周時完成了一份匿名問卷,問卷內容是關於懷孕期間服用阿司匹林的可接受性。
招募來訪時的研究評估包括FMF篩查試驗,對第3組(篩查陽性並服用阿司匹林(3A)和篩查陰性未服用阿司匹林(3B))的結果進行評估。FMF篩選測試在愛爾蘭不是常規做法。篩查試驗的組成部分包括:產婦史(包括排卵誘導受孕、種族、體重指數、年齡、母親是否有先兆子癇);平均動脈血壓(MAP);子宮動脈多普勒搏動指數和;妊娠相關血漿蛋白a (PAPP-A)和胎盤樣生長因子(PLGF)是中位數的幾倍。為了確定子癇前期的風險,采用FMF算法,在篩查陽性率為5%的基礎上,使用42周前子癇前期的臨界值大於1:8。3.選擇這個截止點的目的是捕捉大多數子癇前期患者;無論是早產、產後還是研究開始時,這都是檢測任何先兆子癇的最佳篩選算法。兩名經過培訓的非盲臨床研究超聲師獲得了妊娠早期子宮動脈多普勒波形和MAP並解釋了結果。根據FMF規定的技術,使用自動血壓監測裝置對MAP進行評估。11子宮動脈多普勒測速采用view Version 5.6.16 GE Healthcare, 2012和Voluson Expert 730, GE 2012,采用國際婦產科超聲學會概述的技術。測量雙側子宮動脈搏動指數,取其平均值。12
在醫院臨床生物化學實驗室,采用6000 DELFIA Xpress, PerkinElmer, 2014臨床隨機訪問篩選平台,在標準條件下分析產婦血樣中PAPP-A和PLGF。定量免疫濁度TxBCardio免疫分析法用於測定兩項研究訪問獲得的尿液樣本中的TxB2水平。然後將其與肌酐水平的比值標準化,並表示為pg/mg肌酐。
結果
本研究的主要目的是評估低風險未分娩婦女在懷孕期間服用阿司匹林與試驗指示阿司匹林的可行性和可接受性。結果的措施包括:
同意參加常規開阿司匹林的試驗的合格婦女比例(可行性)。
研究方案的符合性,通過以下方法衡量:(1)阿司匹林的依從性(可接受性),(2)參加研究訪視(可接受性),(3)所有終點和變量的滿意收集(可行性),(4)特定的研究方案違反(可行性)。
有可能獲得妊娠前三個月經腹子宮動脈多普勒測速檢查的婦女比例(可行性)。
在檢查完成後的1周內獲得檢查結果的婦女比例(可行性)。
次要結局包括:(1)子癇前期;(2) SGA嬰兒(定製性別出生體重<10百分位);(3) 34周前早產;(4)入住新生兒重症監護病房(NICU);(5)胎盤早剝;(6)任何報告的死亡(死產、新生兒或嬰兒死亡)和(7)在20-22周通過匿名問卷評估婦女常規服用阿司匹林與試驗指示阿司匹林的可接受性。作為常規產前保健的一部分,婦女可根據醫院的規定與助產士和/或臨床醫生預約(11-14周)、16周、18-20周、25周、28周、31周、34周、36周、38周、40周和41周的妊娠期。在每次就診期間,使用水銀血壓計評估血壓,用尿尺測量蛋白尿,並酌情進行聯合眼底高度和胎兒生物超聲評估。先兆子癇的定義基於國際妊娠期高血壓研究學會的定義,妊娠20周後新發高血壓(收縮壓>140毫米汞柱或舒張壓>90毫米汞柱)與:(1)尿尺測試顯示蛋白尿至少為1克/升(2+),(2)母體器官功能障礙和/或(3)胎兒生長受限(FGR)相關。13產前檢查懷疑被診斷為先兆子癇,因此在胎兒評估單元進行了進一步的調查,包括臨床檢查、血液檢查(尿素和肌酐、肝功能測試和全血圖)、24小時尿蛋白尿收集和產科醫生最終診斷的胎兒超聲評估。
報告了不良和嚴重不良事件的安全性數據,並記錄了停止研究的參與者以及停止的原因和結果。作為產後出血的評估,在分娩時稱重出血量。
統計分析
正如發表的研究方案中所概述的,本研究的預計樣本量為500名婦女,分布在兩個地點,每年共分娩18 000例。8為了確定子癇前期作為主要結局,預期需要的患者數量超過15 000名女性。由於本研究旨在確定該研究的可行性,500名參與者超出了實質性研究所需人數的3% (n=450)。14由於退出率為10% (n=45), 500名參與者足夠獲得主要結果。統計學家使用SAS v.20對意向治療(ITT)人群進行分析,包括所有隨機分組的參與者,他們完成了完整的中期評估。方差測量包括SD。嚴重不良事件的隨訪持續到分娩後28天。不良事件報告為優勢比(ORs),不確定度使用95% ci表示。未進行假設檢驗。
病人參與
盡管患者沒有直接參與設計研究方案和設計,但通過在妊娠20-22周完成的匿名問卷,對RCT幹預的負擔(即服用阿司匹林和接受FMF篩查試驗)進行了評估。在參與研究時,受試者被告知研究結果可在研究網站上發表後查看http://perinatalireland.ie/research/test/
結果
受試者於2014年5月8日至2015年9月23日期間招募,隨訪參與者至2016年4月11日,當最終一名患者交付後,由於達到了目標樣本量,指導委員會結束了研究。總共有1054名符合條件的女性參與了研究,其中557人進行了隨機分組(圖1).在篩查和治療人群(第3組)n=184中,13名(7.1%)婦女有發生>1:8先兆子癇的風險,隨後開始服用阿司匹林直到妊娠36周。11名女性被排除在研究之外,剩下546名ITT患者。根據隨機分組,ITT組共有192名婦女服用阿司匹林,354名婦女未服用阿司匹林。基線特征相似,總結見表1.
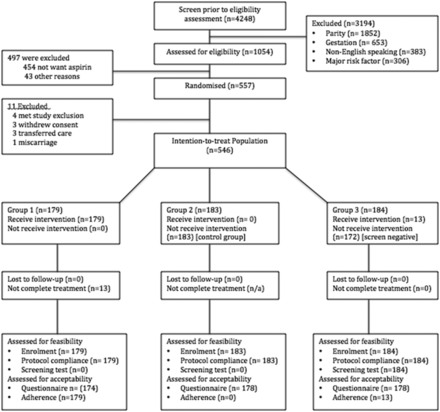
配偶關係圖。
主要的結果
同意參加常規開阿司匹林的試驗的合格婦女比例(可行性);研究人員接觸了1054名符合條件的女性。497人後來沒有登記,因為他們不想服用阿司匹林(n=454)或其他原因(n=43),例如,預約不合適。因此,546/1054(51.8%)名女性願意參與一項可能需要定期服用阿司匹林的研究。
研究方案的符合性,通過以下方式衡量:(A)對阿司匹林的依從性(可接受性),(B)參加研究訪視(可接受性),(C)所有終點和變量的滿意收集(可行性),(D)特定的研究方案違反(可行性):
在參與分析的服用阿司匹林的婦女中(n=192),根據患者日記卡記錄的平均依從性為96.0%,根據藥片計數的平均依從性為95.0%。7名女性不堅持,19名(9.9%)依從性差(<80%)。試驗指示阿司匹林組(3A)和常規阿司匹林組(1)的平均依從性為95.0% (表2).阿司匹林前妊娠早期尿TxB2水平中位數為8662.2 pg/mg (IQR 44.5 - 9931.5),阿司匹林後妊娠中期為2285.1 pg/mg (IQR 591.0-2300.1)。然後評估所有配對樣本的TxB2變化百分比(n=147),發現124/147(84.4%)受試者在妊娠早期和中期TxB2水平下降,而23/147(15.6%)受試者的TxB2水平上升。阿司匹林前後劑量的尿TxB2減少越多,阿司匹林依從性越強圖2.患者組(常規阿司匹林和篩查陽性阿司匹林)在藥片計數、日記卡和尿TxB2變化百分比的依從性測量方麵是相似的。
在接受隨機分組(n=557)的患者中,有11人在完成研究參與要求(第二次研究來訪)前被排除在外。在這11人中,有3人撤回了參與同意書,因為他們決定在隨機分組後不希望服用阿司匹林。
在所有546名受試者中,除了97.1%(530/546)完成了患者可接受性問卷外,收集了所有受試者的結局測量指標和變量。
記錄了6例違反協議的情況(每100名參與者中有0.01例),包括轉到另一家醫院的婦女(n=3),不符合納入標準的婦女的不正確隨機分配(n=2),以及在臨床醫生的建議下開始服用阿司匹林的非阿司匹林組的受試者(n=1)。
有可能獲得妊娠前三個月經腹子宮動脈多普勒測速的婦女比例(可行性);在成功獲得子宮動脈多普勒速度測量後,98.4%(181/184)的患者完成了FMF篩查,其中一項由於腹部獲取困難而在陰道獲得,總體超聲醫生報告獲取的難度為3.1 (SD±0.91)(評分1(容易)至5(無法獲得))(表2).
完成篩選測試的婦女在測試一周內發布結果的比例(可行性);獲得實驗室分析的PAPP-A和PLGF結果以便發布篩查結果的平均時間為7.6天(0-26天),其中78名(42.4%)婦女等待超過一周,5名婦女等待超過16周才能獲得結果(表2).
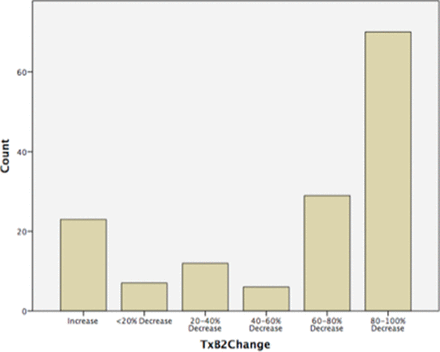
直方圖顯示阿司匹林前後尿血栓素- b2水平變化百分比(n=147) (TxB2=尿血栓素水平)。
二次結果
在次要結果方麵,兩組之間沒有差異補充表S1).在整個隊列中,有3例<34周的早發先兆子癇(0.55%),n=22(4.03%)任何先兆子癇,n=57 (10.44%) SGA嬰兒和15.02% (n=82)胎盤疾病。3A組(篩查陽性阿司匹林)和3B組(篩查陰性無阿司匹林)的次要結果在網上顯示補充表S2.盡管服用了阿司匹林,篩查陽性組與篩查陰性組相比,在<37周發生先兆子癇的人數更多,盡管數量較少(n=2 (15.4%) vs n=2(1.2%))。在後續妊娠中服用阿司匹林方麵,問卷調查顯示92.3%(489/530)的人願意在後續妊娠中服用阿司匹林;92.5%(173/187)阿司匹林服用者和91.5%(314/343)非阿司匹林服用者。
討論
主要發現
這項可行性隨機對照試驗發現,低風險的未生育婦女在懷孕期間對服用阿司匹林持開放態度,並堅持服用,並願意在隨後的妊娠中再次服用。我們可以這麼說,因為與其他懷孕隨機對照試驗的結果相比,該隨機對照試驗的吸收率要高得多,依從性也高得多(如Chiswick、等2015;35%的入學率和65%-67%的依從性使用二甲雙胍)。15這是第一個此類試驗,它評估了低風險妊娠婦女服用阿司匹林的可接受性,以及在常規臨床環境中進行綜合篩查試驗的可行性。
優勢和局限性
本研究的優勢在於多中心隨機對照試驗設計,具有穩健的方案和監督,以及先前發表的方法學。通過使用前瞻性方法限製分配偏差,通過隨機化限製選擇偏差。事實上,同樣的兩名超聲和生物化學家負責進行篩選試驗,使用相同的設備和技術對所有受試者使用測試完成的質量控製標準,優化了重複性。輟學率很低,幾乎所有的患者結果都被記錄了下來。雖然目前沒有有效的科學方法來評估阿司匹林的依從性,16TxB2變化的實驗室評估是一種更客觀的測量方法,從而增強了可靠性。研究的缺點主要是PAPP-A和PLGF分析是在實驗室中使用具有質量保證的經過驗證的方法進行的,而不是在床邊護理點測試,因此需要較長時間才能獲得結果。在非研究環境中,患者的吞吐量更高,可以預期更快的周轉時間。此外。該研究的開放標簽性質意味著安全記錄對報告偏見是開放的,正如隨機對照試驗的情況一樣,受試對象的吸收表現出對受過教育的女性的優勢。在隨機對照試驗中,總是存在引入霍桑效應的風險,即受試者在隨機對照試驗範圍內的行為與在現實環境中的行為不同,因此依從率可能被過度代表。17最後三個月的隨訪可能增加了該研究客觀評估阿司匹林依從性和患者滿意度的力量;然而,由於16周之前的堅持被認為是預防子癇前期的關鍵時間點,因此選擇了20-22周的隨訪。
解釋
最近發表的一項來自FMF的大型隨機對照試驗發現,在應用FMF篩查和隨後將被認為有早產先兆子癇風險的婦女隨機分到阿司匹林150 mg組(與安慰劑組相比)後,阿司匹林組的早產兒先兆子癇發生率有所降低。5我們的研究在幾個方麵有所不同:(1)第三個手臂的常規阿司匹林使用評估常規阿司匹林的提供評估該政策的可接受性和可行性;(2)阿司匹林的劑量(150mg vs 75mg) -鑒於劑量和效果的證據有限,選擇最安全的最低有效劑量。這項研究完成後發表的一項最新薈萃分析表明,阿司匹林存在劑量-反應效應,與標準低劑量相比,孕16周前服用高劑量阿司匹林能更大程度地降低先兆子癇和FGR。18當使用高劑量時有可靠的安全數據支持時,這是未來研究和臨床實踐中需要考慮的問題;(3)不良事件發生率- PPH和陰道出血報告。考慮到較高的阿司匹林劑量方案,這些信息從FMF研究中是有用的;(4)我們的研究沒有發現臨床結果的差異,主要關注的是可行性和可接受性。
很少有研究評估孕期非常規藥物的可接受性。在發展中國家,孕婦願意服用鈣、口服鐵和微量營養素。月19 - 21日如果被告知可能的副作用並經常被提醒,女性會有更高的依從性,最大的障礙是健忘。妊娠期對慢性疾病的平均服藥依從性高於非常規藥物的90%-95%,22因此,我們在自己的研究中注意到如此高的比率是有希望的。通過藥片計數和日記卡評估的依從性與通過TxB2更客觀地評估的依從性存在輕微差異。原因可能包括潛在的阿司匹林耐藥,雖然在本研究中沒有正式評估,但使用腸溶製劑可增加耐藥。23
盡管在獲得實驗室分析的PAPP-A和PLGF方麵遇到延遲,但就獲得妊娠早期子宮動脈多普勒速度測量而言,FMF篩查試驗是可行的。這是相關的,因為它反映了這種篩選測試在臨床現實環境中的實際方麵。需要改進臨床和實驗室工作人員之間的協議,以允許患者在合理的時間內收到結果。
在使用阿司匹林後陰道出血和臨床顯著PPH方麵,盡管產前和產後出血增加的證據需要進一步調查,尤其是使用阿司匹林劑量大於75 mg時,本研究的結果與以前的研究結果相當。24日25日與安慰劑對照相比,由於本研究的開放標簽性質,阿司匹林組的出血報告總是存在潛在的偏倚。雖然在妊娠期通常是安全的,但為了降低PPH的風險(而不是36周),在妊娠期32-34周停止服用阿司匹林可能是值得考慮的,並告知女性陰道點滴增加的不良副作用。
結論
有人提出,減少先兆子癇的最具成本效益的方法是提供有效的、負擔得起的和安全的幹預措施,適用於所有母親,無需事先測試以評估風險水平。7FMF提出的一種基於算法的篩查和治療方法可以在使用150毫克阿司匹林的情況下降低早產子癇前期的發病率。這項研究並沒有發現兩組之間子癇前期發病率的差異,但已經邁出了第一步,以確定低風險的未生育婦女是否願意在第一次分娩時服用阿司匹林,以及應用篩選算法是否可行。下一步,現在需要一項隨機對照試驗來研究在低風險妊娠中普遍使用低劑量阿司匹林與基於篩查的方法相比的療效。由於早發性先兆子癇發病率低,這將需要大量患者。盡管與其他涉及藥物的隨機對照試驗相比,女性對懷孕期間服用阿司匹林持開放態度,但為了獲得足夠的研究參與者,幾乎需要接近兩倍的登記人數。當計劃未來的試驗時,必須考慮到這一點。
致謝
作者對參與研究的女性表示感謝。
參考文獻
腳注
貢獻者構思和設計實驗:FM, CM, PMP, FB, PDo, DMC, MC, AS, FC, JM, SD, JH, AC, ECT, PDi, ZA, FDM, FMA。進行了FM, CM, FC實驗。分析數據:FM, PD, ZA, FMA。貢獻的試劑/材料/分析/工具:PMP, FB, PDo, DMC, MC, AS, JM, SD, JH, AC, AH, ECT, PDi, ZA, FDM, FMA。撰寫論文:FM, CM, PMP, FB, PDo, DMC, MC, AS, FC, JM, SD, JH, AC, AH, ECT, PDi, ZA, FDM, FMA。所有的合著者在審稿人的評論後同意對手稿進行修改。
資金這項研究得到了愛爾蘭HRB和HRB母嬰臨床試驗網絡的支持。
相互競爭的利益沒有宣布。
病人的同意不是必需的。
倫理批準全國婦產醫院中央倫理委員會。
來源和同行評審不是委托;外部同行評議。
數據共享聲明數據集可由通訊作者提供。
請求的權限
如果您希望重用這篇文章的任何部分或全部,請使用下麵的鏈接,它將帶您訪問版權清除中心的RightsLink服務。您將能夠快速獲得價格和以多種不同方式重用內容的即時許可。


